
Читайте также:
|
Для большинства реакций их порядок не соответствует стехиометрии реакции. Обычно реальный порядок реакции ниже стехиометрического и в редких случаях превышает его. Поэтому нахождение реального порядка реакции – чрезвычайно важная операция при выяснении механизмов этой или иной реакции.
В настоящее время для нахождения порядка реакций применяются различные методы: графический и аналитические. Они описаны в литературе.
Решение типовой задачи
k₁B
Задача. Реакция протекает по схеме A
k₂C
Определить константы скорости k₁ и k₂, если известно, что в смеси продуктов реакции содержится 35% вещества В, а концентрация вещества А уменьшается вдвое за 410 с.
Решение. Сумма констант k₁ + k₂ связана с временем пловинного превращения вещества А следующим образом:
k₁ + k₂ =  =
=  ;
;
k₁ + k₂ =  = 1.68 ∙
= 1.68 ∙ 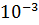 (
( )
)
Отношение констант определяется по выходу веществ В (35%) и С (65%)  =
=  = 0,537
= 0,537
Используя приведенные выше соотношения, получим:
k₂ + 0,537k₂ = 1,68 ∙ 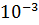 ; 1,537k₂ = 1,68 ∙
; 1,537k₂ = 1,68 ∙ 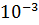
k₂ = 1,09 ∙ 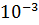 (
( ); k₁ = 0,59 ∙
); k₁ = 0,59 ∙ 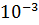 (
( )
)
Задачи для самостоятельного решения
Задача 1. Концентрация промежуточного продукта Вв системе превращений
А k₁Bk₂C достигает максимума через 103 с. Концентрация исходного вещества А уменьшается в 2 раза через 160 с. Определить константы k₁ и k₂.
Ответ: k₁ = 4,31 ∙ 
k₂ = 13,0 ∙ 
Задача 2. Константа скорости реакции дегидрирования вещества А равна 5,0 ∙  при 913 К. За какое время концентрация вещества А уменьшиться в 2 раза? Чему равно среднее время жизни молекулы вещества А?
при 913 К. За какое время концентрация вещества А уменьшиться в 2 раза? Чему равно среднее время жизни молекулы вещества А?
Ответ: t₁/₂ = 138 c
t = 200 c
Литература: [2, с. 284-340; 11,с. 445-521].
2.2 Расчет кинетических параметров термодеструктивных,
термоокислительных и каталитических процессов
переработки горючих ископаемых
Расчет кинетических величин рассмотрим для процессов, проводимых в проточных реакторах. Наиболее простыми и распространенным методом изучения кинетики реакций, осуществляемых в потоке, является исследование изменения xпри измени скорости подачи реагента в реактор n₀. Кинетические уравнения для скоростей проточных реакций, предложенных Г.М. Панченковым, имеют вид:
для гомогенных реакций w =  (95)
(95)
(скорость реакции относится к единице объема);
для гетерогенно-каталитических реакций wS =  (96)
(96)
В этих уравнениях S и l – соответственно сечение и длина реактора: S₀ - поверхность катализатора на единицу длины реактора. Экспериментальная зависимость х=ƒ(n₀) не может быть обработана по уравнениям (95) и (96), так как в них входят другие переменные – х и l.
После преобразования уравнений получим:
w = ―  ∙
∙  =
=  ∙
∙  (97)
(97)
Аналогичное соотношение может быть изучено и для гетерогенных реакций, но в выражение для wS вместо величины S войдет S₀.
Уравнение (97) сожжет быть использовано для непосредственной обработки экспериментальных данных х=ƒ(n₀), так как оно содержит те же перемены.
Рассмотренный метод удобен для определения кинетических величин не только простых, но и сложных реакций в потоке.
Если кривые х=ƒ(n₀) или х=  получены для нескольких температур, то, определяя изменение скорости реакции с температурой, можно рассчитать величину наблюдаемой энергии активации процесса, характеризующей область протекания реакции:
получены для нескольких температур, то, определяя изменение скорости реакции с температурой, можно рассчитать величину наблюдаемой энергии активации процесса, характеризующей область протекания реакции:
Е = ― R  ln
ln  (98)
(98)
С помощью этих соотношений можно найти скорости простых и сложных реакций при разных степенях превращения, т.е. при разных концентрациях реагентов. Изучая изменение скорости при изменении концентраций, определяют порядок реакции и константу скорости реакции.
Изложенный метод применяется при изучении кинетических особенностей различных реакций.
Приведенный выше метод расчета может быть использован для определения вида кинетического уравнения.
Возможные формы кинетических уравнений ряда химических процессов приводятся в таблице 7.
Таблица 7 – Формы кинетических уравнений технических контактных химических процессов.
| Процесс | Кинетическое уравнение |
| Крекинг газойлей | w = k 
|
| Термоконтактный крекинг, гидрокрекинга | w = kpисх |
| Дегидрирование нефтенов, циклизация и изомеризация парафинов при платформинге | w = k 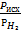
|
| Дегидрирование бутана (прямая реакция) | w = k 
|
| Дегидрирование бутилена (прямая реакция) | w = 
|
Литература: [5,с. 157-179]
Заключение
Химик инженер-технолог должен уметь рассчитывать материальные И тепловые балансы, основные показатели химико-технологических процессов, теплоты химических реакций, химическое равновесие; уметь рассчитывать - пойдет или не пойдет данный химический процесс, какова устойчивость веществ при заданных внешних условиях, каковы будут равновесные, а следовательно, и наибольшие выходы конечных продуктов в.заданных условиях, каковы оптимальные внешние параметры, при которых надо вести процесс; уметь рассчитывать константы скорости и продолжительность химических реакций.
Овладение навыками практических расчетов дает возможность решать основные задачи термодинамического и кинетического анализа процессов химической технологии природных энергоносителей и углеродных материалов,
Применение приведенных основных соотношений, формул, данных в начале каждого параграфа, поможет в решении задач на практических •занятиях, в домашних заданиях и в контрольных работах. Однако, это введение дается только для того, чтобы напомнить основные закономерности, которые используются при решении задач и никак не могут замените учебник по физической химии, химической термодинамике, химической кинетике, к которым нужно обращаться для выяснения неясных вопросов, более глубокого понимания теоретических положений и проводимых расчетов.
Список использованных источников
1. Жоров ЮМ. Термодинамика химических процессов. Нефтехимический синтез, переработка нефти, угля и природного газа - М.: Химия, 1985,-464 с.
2. Стромберг А.Г., Семченко Д.П. Физическая химия: Учеб. для хим.-технол. спец. вузов / Под ред. А.Г. Стромберга.- М; Высш. шк., 1988.- 496 с.
3. Сороко В.Е., Вечная СВ., Попова Н.Н. Основы химической технологии. - Л.: Химия, 1986. -< 296 с.
4. Киреев В.А. Методы практических расчетов в термодинамике химических реакций. - М.: Химия, 1975.- 536 с.
5. Жоров Ю.М. Расчеты и исследования химических процессов нефтепереработки.- М.: Химия, 1973. - 216 с.
6. Казанская А.С., Скобло В.А. Расчеты химических равновесии. Сборник примеров и задач.- М.: Высш. пгк., 1974,- 288 с.
7. Бесков С.Д. Технохимическне расчеты.- М,: Высш. шк.,1966.-520 с.
8. Справочник нефтехимика. Т.1/ Под ред. С.К. Огородннкова.- Л.: Химия, 1978.-496 с.
9. Сарданашвили А.Г., Львова А.И. Примеры и задачи по технологии переработки нефти и газа. - М.: Химия, 1980.- 256 с.
10. Жоров Ю.М. Кинетика промышленных органических реакций: Справ, изд..- М.: Химия, 1989.- 384 с.
11. Справочник нефтехимика. Т.2 / Под ред. С.К. Огородникова.- Л.: Химия, 1978.-592 с.
12. Методические указания к изучению дисциплины «Теоретичесжче основы химической технологии топлива и углеродных материалов» для студентов 4-го курса заочной формы обучения специальности 250400,.-Химическая технология природных энергоносйтелев и углеродных материалов. / Кубан. гос. технол. ун-т.Сост. Н.В. Фролова, ■А.ЮАдзиев. Краснодар. 1999,- 39 с.
Приложение А.
контрольные задания для студентов заочной формы
обучения по дисциплине «Теоретические основы химической
технологии топлива и углеродных материалов»
Студент - заочник, использовав литературу, рекомендованную в [12 ] и в данных методических указаниях, должен выполнить две контрольные работы в процессе самостоятельного изучения дисциплины. В контрольных работах должны содержаться ответы на 4 вопроса:I, II, III, IV из контрольного задания. Каждый вопрос в задании состоит из 15 вариантов. В задании, выданном студенту, указывается номер варианта, например, 12. Контрольная работа должна содержать ответы на вопросы из задания I,12; II,12; III,12; IV.12,
Ответы на вопросы должны быть полными и изложены в том же порядке, в котором они стоят в задании. При необходимости в ответах приводятся уравнения химических реакций, формулы, графики. Размерность единиц физических величин должна даваться в системе СИ. Тексты контрольных заданий должны быть написаны разборчивым почерком в рукописном варианте без сокращений.
Студент должен прорабатывать рекомендованную в методических указаниях учебную литературу, затем приступить к выполнению контрольных заданий. Запрещается дословное переписывание соответствующих разделов из литературы при составлении текстов ответов. Каждое контрольное задание выполняется отдельно и передается для рецензирования в намеченные по графику сроки.
Студент допускается к сдаче экзаменов после выполнения и зачета контрольных работ.
. Контрольное задание № 1
I. Теоретические основы подготовки к переработке и физических мет од ов разделения горючих ископаемых у продуктов их пер еработки.
1) Состав и физические свойства природных и нефтяных газов, 2) Состав и физические свойства углей и сланцев. 3) Состав в физико-химические свойства углерода и углеродных материалов. 4) Подготовка к переработке нефтяных газов. 5} Подготовка нефти к переработке. б'! Подготовка твердых горючих ископаемых к переработке. 7).Состав газоконденсатов и их подготовка к переработке. 8) Основные понятия о топливно-дисперсных системах. 9) Обогащение твердых горючих ископаемых. 10) Физико-химические основы ректификации. 11) Физико-химические основы адсорбции. 12) Физико-химические основы абсорбции. 13) Физико-химические основы экстракции. 14) Физико-химические основыкристаллизации. 15) Физико-хямическне основы мембранных методов разделения.
II. Термодеструктивн ые и термоокислительиые п роцессы перера ботки гор ю чих ископаемых и продуктов их переработки
Теоретические основы: ]) процесса пиролиза; 2) пиролиза в присутствии водорода: 3) образования нефтяного кокса; 4) замедленного коксования; 5) коксования в слое теплоносителя; 6) термического крекинга; 7)Э производства окисленных битумов; 8) полукоксования твердых топлив; 9) коксования твердых топлив; 10) газификации твердых топлив; 11 ) производства углеграфитовых материалов; 12) производства углеродных материалов; 1.3) термоокислительных процессов в жидкой фазе; 14) термоокислительных процессов в твердой фазе; 15) газификации и шффузнонно-кинетической теории горения.
III. Термодинам ика термодес трук тивных, термоокислительных и
уп талитических процессов переработки гор ючих ископаем ых и продуктов их переработки
1) Расчет теплоты каталитического крекинга газойлевых фракций. 2) Расчет теплоты платформинга. 3) Расчет теплот гидрокрекинга парафиновых фракций. 4) Расчет теплот гидрокрекинга парафино-иафтеновых смесей. 5)) Расчет теплот процессов гидроочистки. 6)) Расчет теплоты процессов коксования и получения технического углерода, 7) Расчет теплот процессов изомеризации. 8) Расчет теплот процессов алкилирования. 9) Расчет теплот окисления углеводородов кислородом. 10) Термодинамика реакций крекинга ипиролиза. 11) Термодинамика образования кокса. 12) Термодинамика реакций гидрогенолиза С-С-; С-S-; C-О-; С-N- связей. 13)Термодинамика реакций гидрокрекинга. 14) Термодинамика реакций изомеризации парафиновых углеводородов; 15) Термодинамика реакций алкилировавия парафиновых углеводородов олефиновыми.
IV. Решить задачу
1. Определить тепловой эффект процесса платформинга бензиновой фракции 60-105 °С ло уравнению Жорова и Панченкова, если известно, что выход стабильного катализата 84 % масс; групповой углеводородный состав(в % масс.) сырья: ароматические 6,7; нафтеновые 26,2; парафиновые 67,1; катализата: ароматические 37,2; нафтеновые 1,8; парафиновые 61,0.
2. Подсчитать тепловой эффект процесса гидрокрекинга вакуумного газойля 360-500 °С, если известен выход продуктов (в % масс.) и их качество: газа 16,8 (Мг=45); бензина 50,1 (М₆=130)%; дизельного топлива 24,9 (Мд.т=215); остатка выше 350 8,2 (М₀=380).
3. Подсчитать тепловой эффект процесса гидрокрекинга вакуумного газойля (350-460 °С, d₄20=0,934), если известно, что выходы продуктов (в % масс.) следующие: сухой газ 3,1; бутановая фракция 3,2; фракция 40-82 °С 5,4; фракция 82-149 °С 9,7; фракция 149-288 °С 78,6. Принимают молекулярную массу газа Мг=30.
4.0пределить, возможна ли реакция крекинга гексана при 298 ° К. 
н-пентан изобутан пропилен
Воспользоваться табличными значениями ΔН⁰₂₉₈, S⁰₂₉₈
5. Вычислить константы равновесия ниже перечисленных реакций, по которым возможен крекинг н-эйкозана, показать, какие продукты будут содержаться в равновесной смеси при 800 °К. Реакция протекает в газовой фазе. При 800 °К для всех составляющих данную систему ― lg  :С₂₀Н₄₂ - 75,211; н-С8Н18 27,838; н-С6Н18 - 19,964; С2Н6 - 4,348; С6Н6 -14,434; С12Н24 -45,001; 3-гексен (цис) С 6 Н 12-21,229; циклогексан С6Н12 -20,451; изобутан С4Н8 - 12,974; С3Н6 -9,509; С2Н4 - 6,690.
:С₂₀Н₄₂ - 75,211; н-С8Н18 27,838; н-С6Н18 - 19,964; С2Н6 - 4,348; С6Н6 -14,434; С12Н24 -45,001; 3-гексен (цис) С 6 Н 12-21,229; циклогексан С6Н12 -20,451; изобутан С4Н8 - 12,974; С3Н6 -9,509; С2Н4 - 6,690.
С₂₀H₄₂ ↔ C₁₂H₂₄ + н-C₈H₁₈ (a)
↔ 4C₃H₆ + C₂H₆ + C₆H₁₂ (б)
з-гексен (цис)
↔ C₆H₆ + 3H₂ + C₂H₄ + н-C₈H₁₈ + C₄H₁₈ + C₄H₈ (в)
↔ н-C₆H₁₄ + 2C₄H₈ + C₆H₁₂ (г)
изобутан циклогексан
6. Определить низшую и высшую теплоты сгорания пропана С3Н8, бутана С4Н10, пентана С5Н12.
7. Определить низшую теплотворную способность каменного угля, состав: 73,0 % С; 5,5 % Н2; 8,0 % O2; 2,0 % N2; 1,0 % S; 4,5 % золы; 6,0 % влаги и теоретический расход воздуха.
8. Определить разность между Q_ и  при 25 °С для реакции горения
при 25 °С для реакции горения
водорода с образованием воды в жидком состоянии.
9. Тепловой эффект реакции С+1/2 О₂ = СО при постоянном объеме равен 108,9 кДж/моль при 20 °С. Определить тепловой эффект этой же реакции при постоянном давлении.
10. Теплота реакции неполного окисления углерода при постоянном объеме ΔU=-109372 Дж при 25 °С. Вычислить теплоту реакции ΔН при той же температуре, но при постоянном давлении.
11. Рассчитать теплоты, энтропии, энергии Гиббса, константы равновесия, равновесный состав реакции дегидрирования циклогексана в бензол C₆H₁₂ → C₆H₆ + 3H₂ при 400 и 600 К. Реакционную смесь можно считать идеальным газом. Термодинамические функции реагирующих веществ в состоянии идеального газа при стандартном давлении взять из справочной литературы.
12. Определить тепловой эффект процесса каталитического крекинга вакуумного газойля, если известны выходы продуктов (в % масс): сухого газа 5,5; головки стабилизации 11,5; стабильного бензина 32,4; легкого газойля 23,7; тяжелого газойля 18.9; кокса 8,0.
13. Определить тепловой эффект процесса каталитического риформинга бензина, если известно, что плотность и средняя температура кипения сырья d₄²⁰ = 0,762 и 148 ⁰С, выход продуктов (в % масс.): сухого газа 5,2; бутановой фракции 7,8; катализата (d₄²⁰ = 0,777; 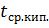 = 130 ⁰С) 87,0.
= 130 ⁰С) 87,0.
14. Определить тепловой эффект процесса коксования гудрона в кипящем слое кокса, если известно, что плотность гудрона d₄²⁰ = 1,0205; выход продуктов (в % масс.): газа 8,8; бензина (40-220 ⁰С, d₄²⁰ = 0,7539) 12,6; газойля (220-546 ⁰С, d₄²⁰ = 0,9488) 57,6; кокса 21,0.
15. Определить тепловой эффект при 15 ⁰С каталитического риформинга бензиновой фракции 122-182 ⁰С плотностью d₄²⁰ = 0,763, если выход продуктов составляет (в % масс.): водорода 1,8; метена 1,8; этана 2,8; пропана 4,2; бутанов 4,6; бензина (d₄²⁰ = 0,775, 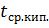 = 112 ⁰С) 84,8.
= 112 ⁰С) 84,8.
Контрольное задание № 2
I.Основы технического катализа.
1)Классификация катализаторов и их роль в протекании химических реакций. 2)Активность катализаторов. 3) Селективность катализаторов. 4) Стабильность катализаторов. 5) Регенерируемость катализаторов. 6) гранулометрический состав катализаторов. 7) Плотность катализаторов. 8) механическая прочность катализаторов на раздавливание и истирание. 9) Пористая структура катализаторов. 10) Фазовый состав катализаторов. 11) Кислотно-основные свойства катализаторов. 12) Эффективные коэффициенты диффузий и теплопроводности катализаторов. 13) Удельная поверхность катализаторов. 14) Носители катализаторов. 15) Принципы подбора катализаторов.
II.Каталитические процессы переработки горючих ископаемых и продуктов их переработки
Теоретические основы: 1) алкилирования изоалканов алкенами; 2) полимеризации алкенов в целях получения компонентов бензина; 3) каталитического крекинга; 4) изомеризации нормальных алканов; 5) каталитического риформинга; 6) гидроочистки; 7) гидрокрекинга; 8) гидродеалкилирования аренов; 9) деструктивной гидрогенизации твердых горючих ископаемых; 10) получения синтетических топлив из СО и Н₂; 11) гидрообессеривания нефтяных остатков; 12) гидрогенизационных процессов; 13) полимеризации олефиновых углеводородов; 14) изомеризации парафиновых углеводородов С₄С₆; 15) алкилирования изопарафиновых и ароматических углеводородов олефиновыми углеводородами.
III.Кинетика термодеструктивных, термоокислительных и каталитических процессов переработки горючих ископаемых и продуктов их переработки.
Кинетика реакций: 1) каталитического крекинга; 2) гидрокрекинга; 3) гидроочистки; 4) гидрогенизации угля; 5) каталитического риформинга; 6)изомеризации; алкилирования; 8) дегидрирования; 9) гидрирования; 10) пиролиза этана; 11) термического разложения метана; 12) образования кокса; 13) жидкофазного каталитического окисления органическихсоединений; 14) термокаталитического окисления органических соединений в газовой фазе; 15) окисления твердых углеграфитовых веществ.
Решить задачу:
1. Концентрация промежуточного продукта В в системе превращений
k₁ k₂
А → В → С достигает максимума через 103 с. Концентрация исходного вещества А уменьшается в 2 раза через 160 с. Определить k₁ и k₂.
2. Константы скорости реакции дегидрирования вещества А равны 5,0 ·  при 913 К. За какое время концентрации вещества А уменьшается в 2 раза? Чему равно среднее время жизни молекулы вещества А?
при 913 К. За какое время концентрации вещества А уменьшается в 2 раза? Чему равно среднее время жизни молекулы вещества А?
3. Константа скорости реакции при 300 К равна 0,02, а при 350 К – 0,6. Какова энергия активации этой реакции?
4. Для одной из реакций опытным путем были определены две константы скорости: при 443 ⁰С – 0,0067, а при 508 ⁰С – 0,1059. Определить энергию активации данной реакции.
5. Вычислить по правилу Вант-Гоффа, на сколько нужно повысить температуру, чтобы скорость реакции возросла в 80 раз, если температурный коэффициент скорости равен 3.
6. Температурный коэффициент реакции равен 3,5. Константа скорости этой реакции при 15 ⁰С равна 0,2 с¯¹. Какова константа скорости реакции при 40 ⁰С.
7. Концентрация промежуточного продукта В в схеме превращений
k₁ k₂
А → В → С достигает максимума через 103 с. Концентрация исходного вещества А уменьшается в 2 раза через 80 с. Определить константы k₁ и k₂.
8. Константа скорости реакции дегидрирования вещества А равна 5,0 ·  при 913 К. За какое время концентрации вещества А уменьшается в 2 раза? Чему равно среднее время жизни молекулы вещества А?
при 913 К. За какое время концентрации вещества А уменьшается в 2 раза? Чему равно среднее время жизни молекулы вещества А?
9. Определить значение константы скорости реакций крекинга и пиролиза: [11, с. 476], реакции 59-65, Т=1350 ⁰К. Проанализировать полученные результаты.
10. Определить значение константы скорости реакций крекинга и пиролиза: [11, с. 478-479], реакции 73,76,79, Т=1350 ⁰К. Проанализировать полученные результаты.
11. Вычислить, на сколько градусов необходимо повысить температура, чтобы скорость реакции возросла в 50 раз, в 100 раз, если температурный коэффициент скорости реакции равен 3.
12. Температурный коэффициент скорости реакции разложения вещества А в области указанных ниже температур равен 2. Вычислить по правилу Вант-Гоффа константу скорости этой реакции при 374 ⁰С, если при 356 ⁰С она равна 0,0000809.
13. Константа скорости реакции при 25 ⁰С равна 9,67 · 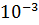 , а при 40 ⁰С – 73,4 ·
, а при 40 ⁰С – 73,4 · 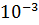 . Определить энергию активации данной реакции в указанном интервале температур.
. Определить энергию активации данной реакции в указанном интервале температур.
14. Константы скорости разложения вещества А при 140 ⁰С равны 5,5 ·  , а при 185 ⁰С – 9,2 ·
, а при 185 ⁰С – 9,2 · 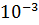 . Вычислить температурный коэффициент реакции в указанном интервале температур.
. Вычислить температурный коэффициент реакции в указанном интервале температур.
15. Вычислить по правилу Вант-Гоффа, при какой температуре реакция закончится за 25 мин, если при 20 ⁰С на это требуется 2 ч. Температурный коэффициент скорости реакции равен 3.
Дата добавления: 2015-02-22; просмотров: 182 | Поможем написать вашу работу | Нарушение авторских прав |