
Читайте также:
|
Законы идеальных газов оказывается тем менее точным для реальных газовых смесей, чем ближе такая смесь к критической точке, т.е. чем выше давление и чем ниже температура смеси.
А. зависимость теплоты реакций от температуры. Для любых систем (см. таблицу 1) справедливо (∂Н/∂Т)р = Ср, (∂∆Н/∂Т)р= ∆Ср. Поэтому уравнение ∆Н⁰ = f(Т) при р=const может быть использовано и для реакций реальных газов.
Б. Зависимость теплоты реакции от давления определяется уравнением (см. таблицу 1):
 T = ∆(hp + u ). (46)
T = ∆(hp + u ). (46)
В соответствии со схемой:
∆Нр
| Реагенты при давлении р | Продукты при давлении р |
Реакция при давлении р
∆Нрасш Расширение ∆Нсж сжатие
реагентов продуктов
| Реагенты при стандартном давлении р0 |
∆Н⁰
Реакция при стандартном
давлении
| Продукты при стандартном давлении р0 |
∆Нр = ∆Нрасш + ∆Н0 + ∆Нсж. (47)
Для реакции в реальной газовой фазе ∆Н0 практически то же, что и для реакции в идеальной газовой фазе, и может быть найдено по теплотам образования или сгорания регулирующих веществ в состоянии идеального газа.
Для большинства реакций давление слабо влияет на теплоту реакции.
В. Зависимость ∆S и ∆G от давления следующая (см. таблицу 2):
 T =
T = 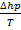 ,
,  T = ∆u, (48)
T = ∆u, (48)
Поскольку h = −T  p и∆h p = −T
p и∆h p = −T  p, (49)
p, (49)
То 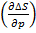 T= −
T= −  p, (50)
p, (50)
∆Gp = ∆Gp₀ + 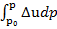 , ∆Sp = ∆Sp₀ −
, ∆Sp = ∆Sp₀ −  (51)
(51)
Интегрирование можно выполнить, используя величины коэффициентов сжимаемости z₁ компонентов и управление состояния для 1 моль в виде: pu = zRT. Тогда
∆u = ∆z  ,
,  p = ∆z
p = ∆z  +
+  p. (52)
p. (52)
Следовательно, ∆Gp= ∆Gp₀ = RT−  , (53)
, (53)
∆Sp = ∆Sp₀ − R  – RT
– RT 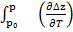 pd ln p. (54)
pd ln p. (54)
В этих выражениях ∆z = ∑Ѵ1z1 = (∑Ѵ1z1)прод. − (∑Ѵ1z1)реаг (55)
Для интегрирования удобно использовать общую зависимость z = z (т πzк) для реального газа.
Расчет величины ∆Sр выполняется по той же схеме, что и расчет ∆Нр, с использованием таблиц и графиков, выражающих разность энтропий реального и идеального газа как функции приведенных параметров (т и π).
Величину ∆Gр обычно находят по значениям ∆Нр и ∆Sр.
∆Gр = ∆Нр − Т∆Sр. (56)
Итак, схема расчета ∆Gр для реакции в реальной газовой смеси следующая:
1) расчет ∆Нр и ∆Sр для реакции в идеальной газовой смеси;
2) расчет ∆Нр и ∆Sр для реакции в реальной газовой смеси;
3) расчет ∆Gр по величинам ∆Нр и ∆Sр
Г. Константы равновесия. Реакция в реальной газовой смеси характеризуется константой равновесия К𝑓.
К𝑓 = П  , К𝑓 = К𝑓(T) (57)
, К𝑓 = К𝑓(T) (57)
и управлением изотермы:
при Т,р-const ∆G = RT(ln П  − ln К𝑓): (58)
− ln К𝑓): (58)
при этом для летучести компонента модно пользоваться соотношением:
𝑓₁ = N₁𝛾₁⁰p. (59)
Если реакция проводится так, что реагенты и продукты находятся в стандартном состоянии идеального газа, то ∆G0 рассчитывают по справочным термодинамическим функциям, и в этом случае
∆G0 = −RTlnKр⁰, (60)
Замена для реальной газовой смеси парциальных давлений летучестями, а константы Кр константой К𝑓приводит к тому, что по величине Kр⁰ удается определить не Кр, а К𝑓. Поскольку К𝑓 можно представить в виде:
К𝑓 = К𝛾КNP∑v₁, (61)
то, очевидно, из упомянутых соотношений
КN =  ∑v₁.(62)
∑v₁.(62)
По величине KN можно рассчитать равновесную степень превращения х, как и в случае идеального газа (см. уравнение 37), так как соотношения связывающие KN и х, не зависят от физических свойств компонентов.
Определение KN и х, включает следующие этапы:
1) расчет по данным стандартных термодинамических таблиц величин ∆G0 и Kр⁰;
2) расчет 𝛾_ для каждого компонента реакционной смеси при условии, что он находится при давлении и температуре реагирующей смеси; расчет величины К𝛾⁰;
3) расчет константы KNиз условия:Kр⁰ = К𝛾⁰KN (р/р⁰)∑v₁; определение по величине KNи соотношению (37) равновесной степени превращения х.
Такой метод дает с удовлетворительной точностью величины KNдодавление 40-50 МПа.
Если химическое изменение описывается одним стехиометрическим уравнением и одной константой равновесия, то это, так называемая, простая реакция. В подавляющем большинстве реализуемых процессов одновременно протекают несколько реакций. Такие процессы характеризуются несколькими стехиометрическими уравнениями и соответственно несколькими константами равновесия.
В случае сложного равновесия теплоты и константы равновесия каждой простой стадии (простой реакции) определяют так, если бы в системе протекала только эта реакция.
В таблице 5 приведены теплоты основных процессов превращения углеводородного сырья [1,с.134].
Таблица 5 – Теплоты различных превращений индивидуальных углеводородов.
| Реакция | Теплота реакции ∆Н⁰ (кДж/моль) при температурах. К | ||
| Крекинг нормальных парафинов (до н-парафина и этилена): н-С₆Н₁₄→ С₂Н₄ + н-С4Н10 н-С8Н₁₈→ С₂Н₄ + н-С₆Н₁₄ н-С₁₀Н₂₂→ С₂Н₄ + н-С₈Н₁₈ н-С₁₂Н₂₆→ С₂Н₄ + н-С₁₀Н₂₂ (до н-парафина и н-олефинов С₃-С₅): н-С₁₂Н₂₆→ С₃Н₆ + н-С₉Н₂₀ н-С₁₂Н₂₆→ н-С₄Н₈ + н-С₈Н₁₈ н-С₁₂Н₂₆→ н-С₅Н₁₀ + н-С₇Н₁₀ Изомеризация нормальных парафинов: н-С₆Н₁₄→ изо-С₆Н₁₄ н-С₈Н₁₈→ изо-С₈Н₁₈ Изомеризация шестичленных нафтенов (до пятичленных нафтенов): С₆Н₁₂→ н-С₅Н₉― СН₃ С₆Н₁₁СН₃→ С₅Н₈(СН₃)₂ Дегидроциклизация парафинов (с образованием нафтенов): н-С₆Н₁₄→ С₆Н₁₂ -Н₂ н-С8Н₁₈→ С₆Н₁₁ ― С₂Н₅ -Н₂ н-С₁₀Н₂₂→ С₆Н₁₁ ― н-С₄Н₁₀ -Н₂ н-С₁₂Н₂₆→ С₆Н₁₁ ― н-С₆Н₁₃ -Н₂ Дегидрирование шестичленных нафтенов (до ароматических углеводородов): С₆Н₁₂→ С₆Н₆ -3Н₂ С₆Н₁₁― С₂Н₅ → С₆Н₅ ― С₂Н₅ -3Н₂ С₆Н₁₁― С₄Н₉ → С₆Н₅ ― С₄Н₉ -3Н₂ Гидрокрекинг парафинов (с образованием метана и н-парафина): + Н₂ н-С₄Н₁₄→ СН₄ + н-С₅Н₁₂ + Н₂ н-С₈Н₁₈→ СН₄ + н-С₇Н₁₆ + Н₂ н-С₁₀Н₂₂→ СН₄ + н-С₉Н₂₀ | 91,1 91,1 91,1 91,1 78,6 79,0 79,0 -6,3 -4,2 15,5 16,7 45,1 40,5 41,4 41,4 219,9 212,8 209,8 -60,6 -60,6 -60,6 | 90,3 90,7 90,3 90,3 77,7 77,7 77,7 -5,9 -4,2 14,2 15,5 46,4 42,6 43,1 43,1 220,9 212,8 209,8 -61,9 -61,9 -61,9 | 89,5 89,9 89,9 89,9 76,5 76,9 76,9 -5,9 -4,2 13,4 14,2 47,7 44,3 44,7 45,1 219,9 211,5 209,0 -63,5 -63,5 -63,5 |
Полученные результаты позволяют рассчитывать теплоты сложных процессов.
Решение типовой задачи
Задача. Рассчитать теплоты, энтропии, энергии Гиббса, константы равновесия, равновесный состав реакции дегидрирования циклогексана в бензолС₆Н₁₂ → С₆Н₆+ 3Н₂ при 300 и 800 ⁰К. Реакционную смесь можно считать идеальным газом.
Термодинамические функции реагирующих веществ в состоянии идеального газа при стандартном давлении:
| Вещество | 300⁰К | 800⁰К | ||
| ∆Н⁰об, кДж/моль | S, Дж/(моль ∙ К) | ∆Н⁰об, кДж/моль | S, Дж/(моль ∙ К) | |
| Циклогексан Бензол Водород | -123,34 | 298,9 269,7 130,8 | -155,60 64,90 | 448,1 402,1 159,4 |
Дата добавления: 2015-02-22; просмотров: 103 | Поможем написать вашу работу | Нарушение авторских прав |