
Читайте также:
|
Задача 1-2. Рассчитать теплоты, энтропии, энергии Гиббса, константы равновесия, равновесный состав реакции дегидрирования циклогексана в бензол С₆Н₁₂→ С₆Н₆ + 3Н₂ при 1) 400 и 600 К; 2) 500 и 700 К.
Реакционную смесь можно считать идеальным газом.
Термодинамические функции реагирующих веществ в состоянии идеального газа при стандартном давлении:
| вещество | 400 К | 500 К | 600 К | 700 К | ||||
| ∆Н⁰обр, _кДж_ моль | S⁰, __ Дж__ моль ∙ К | ∆Н⁰обр, _кДж_ моль | S⁰, __ Дж__ моль ∙ К | ∆Н⁰обр, _кДж_ моль | S⁰, __ Дж__ моль ∙ К | ∆Н⁰обр, _кДж_ моль | S⁰, __ Дж__ моль ∙ К | |
| Циклогексан | -134,14 | 335,64 | -142,59 | 373,51 | -148,82 | 411,37 | -153,05 | 488,36 |
| Бензол | 77,66 | 297,52 | 73,39 | 325,31 | 69,91 | 352,21 | 67,11 | 377,86 |
| Водород | 139,12 | 145,64 | 150,98 | 155,51 |
Литература: [1, с. 73-80; 5, с. 208-211; 6, с. 162-195]
1.7 Расчет теплоты процессов переработки углеводородного сырья характерно протекание одновременно большого числа реакций, причем индивидуальный состав сырья и продуктов не всегда может быть определен. Табличные свойства индивидуальных веществ обычно не удается использовать. Для расчета теплоты технического процесса применяют различные методы. Один из них – расчет по закону Гесса. При расчете теплового эффекта процесса по закону Гесса даже небольшая неточность в значениях теплоты сгорания или выхода продуктов приводит к весьма большим погрешностям. Однако закон Гесса широко применяют для подсчета тепловых эффектов процессов. Расчет ведут следующим образом:
1. Составляют материальный баланс процесса
А = Х₁Б + Х₂В + Х₃Г, (63)
Где А – сырье процесса; Б, В, Г, - полученные продукты;
Х₁, Х₂, Х₃ - выходы полученных продуктов, массовые доли.
2. Определяют теплоту сгорания сырья и продуктов любым доступным методом.
3. Тепловой эффект процесса при нормальной температуре (qр, кДж/моль сырья) подсчитывают по разности теплот сгорания исходного сырья и полученных продуктов
qр = Q ― X₁Q₁ ― X₂Q₂ ― X₃Q₃, (64)
где Qp, Q₁, Q₂, Q₃ - теплоты сгорания соответственно сырья и получаемых продуктов, кДж/кг сырья.
4. Для подсчета теплового эффекта при температуре процесса:
― определяют разность энтальпий исходного сырья при температуре процесса (НА) и при нормальной температуре (Н’А), т.е. тепло, необходимое для нагревания сырья до температуры процесса
q₁ = НА ― Н’А (65)
― находят энтальпию продуктов при температуре процесса и прибавляют к ней тепловой эффект процесса при нормальной температуре, т.е. определяют необходимое тепло для проведения процесса при нормальной температуре и нагревания полученных продуктов до температуры процесса.
q₂ = Нб’ ― Нв’― Нг’ ― qр(66)
Тепловой эффект при температуре процесса составляет:
qр’ = q₂ ― q₁ (67)
Для расчета теплового эффекта (qр кДж/кг сырья) каталитического риформинга при 500 ⁰С. Ю. М. Жоров, Г. М. Панченков и др. вывели уравнение:
qр = 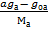 ∙ 312,5 ∙ 103 +
∙ 312,5 ∙ 103 +  ∙ 98,0 ∙ 103 +
∙ 98,0 ∙ 103 + 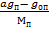 ∙ 56,1 ∙ 103, (68)
∙ 56,1 ∙ 103, (68)
где a – массовый выход стабильногокатализата, масс;
gоа,gон,gоп ― содержание ароматических, нафтеновых и парафиновых углеводородов в сырье, массовые доли;
gа,gн,gп― то же – в катализате, массовые доли;
Ма,Мн,Мп ― молекулярные массы ароматических нефтеновых и парафиновых углеводородов.
Молекулярная масса различных углеводородов равна:
Ма= 14m ― 6; Мн= 14m; Мп= 14m + 2. (69)
Среднее число атомов в молекуле сырья (m) определяется по формуле:
M =  (M ― 2Nон + 6Nоа), (70)
(M ― 2Nон + 6Nоа), (70)
где М – средняя молекулярная массы сырья, которую можно рассчитать по формуле Б.М. Войнова;
Nон, Nоа - содержание парафиновых и ароматических углеводородов в сырье, мальные доли.
Формула Б.М. Войнова для определения молекулярной М нефтяной фракции:
М = a + bt + ct², (71)
где t – средне-молекулярная температура кипения фракции, ⁰С;
a,b,c, - коэффициенты.
Для парафиновых углеводородов формула Б.М. Войнова имеет вид:
М = 60 + 0,3t + 0,001t² (72)
Данная формула применима и для узких бензиновых фракций.
Но так как обычно состав сырья дается в массовых долях (m), то приближенно определяют:
M =  (M ― 2gоп + 6gоа), (73)
(M ― 2gоп + 6gоа), (73)
Затем по уравнению (69) приближенно определяют Ма, Мн, Мп;
Мольные доли N определяют по уравнению:
N = 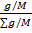 (74)
(74)
Подстановка приближенных величин N в уравнение (70) дает уточненную величину m.
Ю. М. Жоров и Г. М. Панченков разработали аналитический метод расчета теплот (qp’, кДж/моль сырья или qp, кДж/кг сырья) гидрокрекинга парафиновых фракций. Пусть, например, сложный процесс гидрокрекинга описывается общим уравнением:
СnН₂n+2 + rH₂ → vk’CkH₂k+2 + vl’ClH₂l+2 + vm’CmH₂m+2 + …= ∑ vi’CiH₂i+2, (75)
Где n – среднее число атомов углеводорода в молекуле сырья;
r – число молекул водорода, вступившего в реакцию;
k,l,m, - среднее число атомов углерода в молекулах продуктов гидрокрекинга;
vk’,vl’,vm’- количество продуктов (в моль), образовывавшихся из 1 моль сырья.
При разработке аналитического метода расчета авторы исходят из числа связей С-С и их энергии. В парафиновом углеводороде CiH₂i+2 число связей С-С всегда равно i=1. Найдено, что число атомов углерода в молекуле парафинового углеводорода всегда составляет:
i=  , (76)
, (76)
Где Мi– молекулярная масса парафинового углеводорода.
Значит число атомов углерода в молекулах сырья и продуктах реакции будет равно:
n =  ; k =
; k =  ; i =
; i =  ; m =
; m = 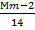 .(77)
.(77)
Только мольную теплоту реакции можно подсчитать следующим образом (в кДж/моль):
qp’ = h 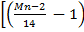 ―vk’
―vk’ 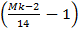 ―vi’
―vi’ 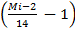 ―vm’
―vm’  =
=
= 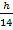 [(Mn ― 16) ― ∑vi’ (Mi ―16)] (78)
[(Mn ― 16) ― ∑vi’ (Mi ―16)] (78)
где h – теплота разрыва одной С-С связи с гидрированием и изомеризацией образовавшихся молекул в результате реакции гидрокрекинга, кДж/моль.
qp = 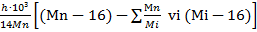 (79)
(79)
где vi – массовые коэффициенты, представляющие собой массовые выходы продуктов на 1 кг сырья, % масс, массовые доли.
Для реальных процессов гидрокрекинга, которые приводят при температуре около 400⁰С, можно принять h = -62,8 кДж/моль. Тогда
qp= 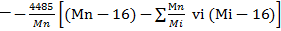 (80)
(80)
Таким образом, можно подсчитать тепловой эффект процесса гидрокрекинга парафинового сырья для индивидуальных углеводородов и для технических смесей, подставив молекулярную массу сырья и продуктов зная массовые выходы продуктов на 1 кг сырья (в % масс.).
В таблице 6 приведены тепловые эффекты процессов деструктивной переработки нефти и газа [9, с. 207].
Таблица 6 ― Тепловые эффекты процессов деструктивной переработки нефти и газа.
| Процессы | Тепловой эффект, кДж/кг сырья |
| Термические Термический крекинг: газойля мазута гудрона (легкий) Пиролиз: этапа пропана н-бутана бензина Коксование гудрона: замедленное контактное Термическоедеалкилирование толуола Каталитические Каталитический крекинг газойля Каталитическийриформинг бензина: парафинового нефтеного Каталитическая изомеризация парафиновых углеводородов Гидрокрекинг парафинового сырья Переработка углеводородных газов Каталитическая полимеризация: пропилена бутилета каталитическоеалкилирование изобутана бутиленам | от +1257 до +1466 (на 1 кг бензина) от +1257 до +1676 (на 1 кг бензина) от +125 до +230 +4470 от +1257 до 1466 +1257 от +1466 до +2095 от +84 до +170 +209 -544 от +209 до +272 (на 1 кг бензина) от +293 до +628 (на 1 кг бензина) от +209 до +293 от +419 до +586 от -71 до -113 от -293 до 419 -1550 -725 от -733 до 963 (на 1 кг бензина) |
Дата добавления: 2015-02-22; просмотров: 81 | Поможем написать вашу работу | Нарушение авторских прав |