
Читайте также:
|
ХІМІЧНА КІНЕТИКА. ХІМІЧНА РІВНОВАГА
Хімічні перетворення супроводжуються перебудовою електронних структур частинок реагуючих речовин (атомів, молекул, іонів тощо) і утворенням нових частинок з новими електронними структурами та властивостями. Відповідно швидкість хімічної реакції та механізм її перебігання залежать від міцності хімічного зв'язку в існуючих частинках. Чим легше руйнуються ці зв'язки, тим більшою буде швидкість реакції.
Розділ хімії, який вивчає швидкість та механізм хімічних перетворень, називають хімічною кінетикою. Основна задача хімічної кінетики — управління хімічним процесом з метою досягнення максимальної швидкості реакції та максимального виходу продукту реакції.
Реакції можуть бути гомогенними та гетерогенними. У гомогенних вихідні речовини та продукти реакції знаходяться в однаковому агрегатному стані (в одній фазі). Це реакції між газами або між розчинами.
Реакції між речовинами, які знаходяться в різних агрегатних станах або в різних фазах, називають гетерогенними.
Хімічна взаємодія у випадку гомогенної реакції відбувається у всьому об'ємі реагуючої суміші; гетерогенна реакція відбувається лише на межі розподілу фаз. Перебіг гомогенних і гетерогенних реакцій у багатьох випадках різний. Тому говорять про кінетику гомогенних і гетерогенних реакцій.
Швидкість хімічної реакції
Швидкістю хімічної реакції називають число елементарних актів. реакції, які відбуваються за одиницю часу в одиниці об'єму (у випадку гомогенної реакції) або на одиниці поверхні розподілу фаз (у випадку гетерогенної реакції). Кількісно швидкість реакції звичайно характеризують зміною концентрації реагуючої речовини за одиницю часу. При цьому концентрацію (С) виражають числом молей речовини в одному літрі, а час (t) — в секундах. Для обчислення швидкості хімічної реакції досить знати зміну концентрації однієї з речовин за одиницю часу, оскільки концентрації інших
речовин визначають за стехіометричними коефіцієнтами рівняння реакції. Не має значення, концентрацію якої з речовин розглядати, слід лише враховувати, що концентрації вихідних речовин внаслідок реакції будуть зменшуватися, а продуктів — зростати.
Швидкість даної хімічної реакції за незмінних зовнішніх умов з часом змінюється. В міру того як витрачаються вихідні речовини, швидкість процесу зменшується (рис. 29).
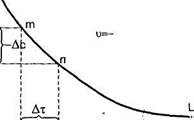
Рис. 29. Зміна концентрації речовини за час її хімічного перетворення
Тому числові значення швидкості реакції будуть різними в залежності від того, за який проміжок часу розглядають зміну концентрацій. Якщо за проміжок часу τ2 — τ1, концентрація однієї з реагуючих речовин змінилася від початкової С1 до кінцевої С2, то визначають середню швидкість реакції Vcep за даний проміжок часу:

Якщо віднести зміну концентрації до нескінченно малого проміжку часу, то можна визначити миттєву швидкість реакції V на даний момент як похідну від концентрації за часом:
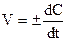
У хімічній кінетиці розглядають лише дійсну швидкість.
Відношення  та похідна
та похідна  можуть бути як додатними, так і від'ємними. Якщо С1 — концентрація однієї з вихідних речовин, то С2< С1 та —
можуть бути як додатними, так і від'ємними. Якщо С1 — концентрація однієї з вихідних речовин, то С2< С1 та —  < 0. Тому для того, щоб швидкість мала додатне значення, праву частину з рівнянь середньої та миттєвої швидкостей необхідно брати із знаком мінус.
< 0. Тому для того, щоб швидкість мала додатне значення, праву частину з рівнянь середньої та миттєвої швидкостей необхідно брати із знаком мінус.
Зміну швидкості процесу можна спостерігати за зміною будь-якої властивості системи: якщо одна з вихідних або одержаних речовин газ — за зміною об'єму або тиску в закритій посудині при сталій температурі. Інколи можна спостерігати за появою осаду, зміною забарвлення, електропровідності.
Швидкість хімічної реакції залежить від ряду факторів: природи реагуючих речовин, концентрації, температури, поверхні дотику (для гетерогенних реакцій), наявності каталізаторів, освітлення для фотохімічних реакцій.
Дата добавления: 2015-02-16; просмотров: 125 | Поможем написать вашу работу | Нарушение авторских прав |