
Читайте также:
|
1. Природные источники. Фенол получают при сухой перегонке каменноугольной смолы. Вторая фракция с tкип 150—230 °С содержит фенол. Впервые фенол был получен таким способом Ф. Рунге в 1834 г.
2. При нагревании галогенопроизводных бензола со щелочами в присутствии катализатора:

3. Сплавление натриевых солей сульфокислот со щелочами:

4. Разложение солей диазония:

5. Окисление кумола (кумольный способ). Это основной промышленный способ получения фенола:

Способ является экономически выгодным, так как позволяет кроме фенола получить и другой важный продукт — ацетон.
Химические свойства
Для фенолов характерны два направления реакций: реакции по фенольному гидроксилу и по ароматическому ядру.

|
В молекуле фенола имеет место сопряжение неподеленной пары электронов атома кислорода гидроксильной группы с π-электронами бензольного ядра. Это приводит к довольно сильной поляризации связи
0←Н, что объясняет более выраженный кислотный характер фенолов в сравнении со спиртами. Атомы водорода гидроксильной группы приобретают подвижность и довольно легко замещаются на другие атомы или атомные группы.
С другой стороны, наличие положительного мезомерного эффекта приводит к укорачиванию связи С—ОН, что делает практически невозможными реакции замещения фенольного гидроксила.
Реакции с участием группы ОН
1. Кислотные свойства. Фенолы обладают кислотным характером, они способны образовывать соли уже при действии щелочей:

В водном растворе феноляты подвергаются частичному гидролизу, т. к. образованы слабой кислотой и сильным основанием. По этой причине их растворы имеют щелочную реакцию. Минеральные кислоты, в том числе и угольная, вытесняют фенолы из их солей.
На кислотность фенола оказывают влияние заместители в ароматическом ядре. При наличии в «-положении электроноакцепторных заместителей (-N02, -Вг, -Cl, -CN и др.) кислотные свойства усиливаются. Если в «-положение ввести электронодонорные заместители (-NH2, -ОСН3 и др.), то происходит снижение кислотных свойств, поскольку уменьшается смещение электронов связи О—Н к атому кислорода, что затрудняет отрыв протона:

2. Образование простых и сложных эфиров. Простые эфиры фенола непосредственно из фенола получить не удается. Дня их получения используют реакцию Вильямсона: взаимодействие феноксида натрия с галоидными алкилами или арилами

При взаимодействии фенолятов с галогенаренами образуются ароматические простые эфиры:

Дифениловый эфир имеет запах герани.
Ароматические простые эфиры имеют схожие химические свойства с простыми эфирами алифатического ряда. Они не взаимодействуют со щелочами, разложить их можно только йодоводородной кислотой.
Взаимодействие фенолятов с галогенангидридами карбоновых кислот приводит к образованию сложных эфиров:

Аналогичные продукты также получают по реакции ацилирования самих фенолов с ангидридами карбоновых кислот:

Такая реакция называется О-ацилированием.
В отличие от спиртов фенолы не этерифицируются непосредственно карбоновыми кислотами из-за недостаточной электронной плотности на атоме кислорода.
3. Взаимодействие фенолята натрия схлоруксусной кислотой. Примером реакции О-алкилирования является реакция получения фенок- сиуксусной кислоты:

Феноксикислоты являются твердыми полупродуктами с четкой температурой плавления и служат для идентификации фенолов. Феноксиуксусная кислота имеет большое значение в синтезе фармацевтического препарата феноксипенициллина. Пенициллин — это природный антибиотик, который образуется в результате размножения плесени. В настоящее время пенициллин получают в медицинской промышленности в больших чанах, в которых произрастает плесень. Однако природу пенициллина можно изменять. Если в питательную среду плесени добавить феноксиуксусную кислоту, получают феноксиметил-пенициллин, который более устойчив, чем обычный пенициллин.

Аналогично получают 2,4-дихлорфеноксиуксусную кислоту — стимулятор роста растений.
Реакции по ароматическому ядру
Гидроксильная группа является одним из самых сильных доноров электронов (+М), она значительно повышает электронную плотность в бензольном ядре и тем самым увеличивает его реакционную способность в реакциях SE.
1. Бромирование. При взаимодействии фенола с бромной водой в отсутствии катализатора в молекулу вводится три атома брома и образуется 2,4,6-трибромфенол:

Эта реакция используется для качественного и количественного определения фенола.
Для введения одного или двух атомов брома в бензольное кольцо реакцию бромирования проводят в низкополярных растворителях (СС14, СНС13):

2. Нитрование. Если бензол нитруется только нитрующей смесью, то фенол можно нитровать разбавленной азотной кислотой при комнатной температуре:
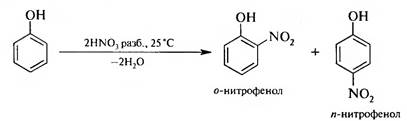
В этих условиях в молекулу фенола вводится одна нитрогруппа. Полученную смесь нитрофенолов можно разделить перегонкой с водяным паром. В связи с тем, что в молекуле о-нитрофенола гидроксильная и нитрогруппа находятся рядом, между атомом водорода ОН-груп- пы и атомом кислорода NOj-группы образуется внутримолекулярная водородная связь (ВВС):
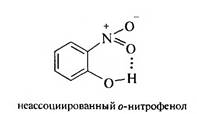
Подобные соединения легколетучи. Как видно, образуется 6-членный цикл за счет хелатной водородной связи (внутримолекулярная водородная связь называется хелатной).
Молекулы пара-изомера образуют межмолекулярные водородные связи (МВС):

Для п- и о-нитрофенолов характерна бензоидно-хиноидная таутомерия. Мета-нитрофенолы не являются таутомерными веществами, так как в них нет сопряжения между ОН- и NO2-группами.

Свободные нитрофенолы — бесцветные вещества или имеют желтую окраску. При добавлении щелочей образуются соли нитрофенолов, окрашенные в ярко-желтый цвет.
При действии концентрированной азотной кислоты на фенол образуется осадок 2,4 6-тринитрофенола:

2,4,6-Тринитрофенол называется пикриновой кислотой, по кислотности он приближается к серной кислоте.
3. Сульфирование. Сульфирование фенола проходит очень легко и в зависимости от температуры приводит к о- или п-изомерам:

4. Алкилирование и ацилирование. Реакции алкилирования и аци- лирования по бензольному кольцу (С-алкилирование и С-ацилирование фенолов) проводят в условиях реакции Фриделя — Крафтса:

5. Азосочетание. Фенолы в качестве азосоставляющей в слабощелочной среде вступают в реакцию азосочетания с солями диазония с образованием азосоединений:

6. Синтез фенолкарбоновых кислот (реакция Кольбе — Шмитта). При пропускании углекислого газа через раствор фенолята натрия образуется салицилат натрия, который при действии минеральных кислот образует салициловую кислоту.

7. Тидроксиметилирование. При обработке фенолов формальдегидом в кислой или щелочной среде образуется смесь о- и и-гидрокси-метилфенолов. Реакция протекает по механизму SE, электрофильной частицей в условиях кислотного катализа является гидроксиметил-катион +СН2ОН:

В присутствии минеральных кислот гидроксиметилфенол вступает в реакцию конденсации с молекулой фенола:

В более жестких условиях образуются высокомолекулярные продукты поликонденсации — фенолоформальдегидные смолы.

В результате такой реакции поликонденсации могут образовываться смолы линейного или сетчатого строения.
Дата добавления: 2015-09-11; просмотров: 109 | Поможем написать вашу работу | Нарушение авторских прав |