
Читайте также:
|
Кислотные свойства фенола (карболовой кислоты) выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических.
| Тип реакции | Уравнение |
| I. Окисление | |
| 1. Полное окисление (горение) | С6Н5ОН+7О2 → 6СО2 + ЗН2О |
| II. Реакции с участием ФГ ОН | |
| 1. Реагируют со щелочными и щелочноземельными металлами, образуя феноляты (сходство со спиртами). | 2C6H5ОH+2Na → 2C6H5ONa + H2 |
| 2. Реагируют с растворами щелочей, образуя феноляты (отличие от спиртов). | C6H5OH+NaOH → C6H5ONa + H2О |
| 3. Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета - фенолят железа. | C6H5OH + FeCl3 → (C6H5O)3Fe + 3HCl фенолят железа |
| III. Замещение в бензольном кольце | |
| 1. Реакция с бромной водой (качественная реакция). Галогенирование идёт при обычных условиях. |  + 3Br2 → + 3Br2 → 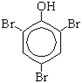 +3HBr
Или С6Н5ОН+ ЗВг2 → С6Н2Вг3ОН + ЗНВr
Образуется 2,4,6-трибромфенол - осадок бело-жёлтого цвета. +3HBr
Или С6Н5ОН+ ЗВг2 → С6Н2Вг3ОН + ЗНВr
Образуется 2,4,6-трибромфенол - осадок бело-жёлтого цвета.
|
| 2. Нитрование (при комнатной температуре), применяется нитрующая смесь – смесь конц. азотной и серной кислот при нагревании. |  + 3HNO3(конц.) → + 3HNO3(конц.) →  +3H2O
Образуется 2,4,6-тринитрофенол (пикриновая кислота)- С6Н5(NО2)3OН. +3H2O
Образуется 2,4,6-тринитрофенол (пикриновая кислота)- С6Н5(NО2)3OН.
|
| IV. Поликонденсация | |
| 1. Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы). | 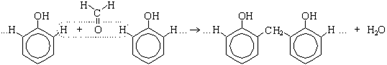
|
Дата добавления: 2015-09-11; просмотров: 83 | Поможем написать вашу работу | Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Характерные химические свойства предельных многоатомных спиртов | | | Я Есмь здесь и сейчас! Наслаждаюсь жизнью и игрой! У Вас для этого есть всё! . Не ждите чудес - творите их сами! |