
Читайте также:
|
I. Кислотно-оснóвные свойства. Спирты – слабые амфотерные соединения.
1. Взаимодействие с натрием (кислотные свойства)
2С2H5–ОН + 2Nа ® 2 С2H5–ОNа + Н2
этилат натрия
Алкоголяты легко гидролизуются, что показывает – спирты более слабые кислоты, чем вода:
С2H5– ОNа + НОН ® С2H5–ОН + NаОН
2. Взаимодействие с сильной кислотой НС1 (основные свойства). Оснóвным центром в спиртах является атом О, обладающий неподелённой парой электронов. При действии на спирты сильными кислотами происходит присоединение Н+ к атому кислорода группы ОН и образуется неустойчивый алкилоксониевый ион:
 Этилоксоний хлорид
Этилоксоний хлорид
II. Реакции SN по гр. –ОН
Гр. -ОН является плохоуходящей группой (связь мало полярна), поэтому большинство реакций проводят в кислой среде. Механизм р-ции:
 СН3-СН2-ОН + Н+ ® СН3-СН2-
СН3-СН2-ОН + Н+ ® СН3-СН2-  -Н ® СН3-СН2+ + Н2О
-Н ® СН3-СН2+ + Н2О
1. Взаимодействие с галогеноводородами:
Если реакция идет с галогеноводородами, то присоединяться будет галогенид-ион: СН3-СН2 - ОН + НСl ® СН3-СН2Сl + Н2О
2. Реакция алкилирования (введение алкила R в молекулу).
Заместить –ОН гр. на галоген можно при действии РСl3, РСl5 и SОСl2, например:
С2Н5ОН + РСl5 → С2Н5Сl + HCl + POCl3
С2Н5ОН + SOСl2 → С2Н5Сl + HCl + SO2
По такому механизму легче реагируют третичные спирты.
III. Реакции SЕ.
К ним относятся реакции взаимодействия спиртов с органическими и минеральными кислотами с образованием сложных эфиров:
1. Взаимодействие с уксусной кислотой.
 С2H5 – О Н + Н О –
С2H5 – О Н + Н О – 
 СН3 – О –
СН3 – О –  + Н2О
+ Н2О
этиловый эфир уксусной кислоты
2. 
|
этилнитрат
IV. Реакции Е (отщепления, или элиминирования)
Эти реакции конкурируют с реакциями SN.
 СН3-СН2-ОН + Н+
СН3-СН2-ОН + Н+  СН3-СН2-
СН3-СН2-  -Н
-Н  СН3-СН2+
СН3-СН2+
При избытке Н2SО4 и более высокой температуре, чем в случае реакции образования простых эфиров, идет регенерация катализатора и образуется алкен:
СН3-СН2+ + НSО4- ® СН2 = СН2 + Н2SО4
Легче идет реакция SE для третичных спиртов, труднее для вторичных и первичных, т.к. в последних случаях образуется менее стабильные катионы. В данных реакциях выполняется правило А. Зайцева: «При дегидратации спиртов атом Н отщепляется от соседнего атома С с меньшим содержанием атомов Н».

 СН3-СН = СН -СН3
СН3-СН = СН -СН3
Бутанол-2 бутен - 2
В организме гр. –ОН превращается в легкоуходящую путем образования эфиров с Н3РО4:
 СН3-СН2-ОН + НО–РО3Н2
СН3-СН2-ОН + НО–РО3Н2  СН3-СН2-ОРО3Н2
СН3-СН2-ОРО3Н2
V. Реакции окисления
1. Первичные и вторичные спирты окисляются СuО, растворами КМnО4, К2Сr2О7 при нагревании с образованием соответствующих карбонилсодержащих соединений:
|

|
 СН3-СН2-
СН3-СН2-  -ОН + О
-ОН + О  СН3-CH2-
СН3-CH2-  -ОН
-ОН  СН3-СН2-
СН3-СН2-  -Н
-Н



|
 - СН3 + О
- СН3 + О  СН3-
СН3-  - СН3
- СН3  СН3-
СН3-  СН3
СН3
Ацетон (кетон)
5CH3OH + 6KMnO4 + 9H2SO4 → 5CO2↑ + 6MnSO4 + K2SO4 + 19H2O
5C2H5OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O
Окисление спиртов под действием дихроматов натрия или калия является качественной реакцией. В результате взаимодействия спирт окисляется, а дихромат – ион восстанавливается до Cr+3, в результате чего оранжевое окрашивание переходит в сине-зеленое.
Cr2O72- + 14H+ + 6 ẻ → 2Cr3+ + 7H2O
оранжевый сине-зеленый
на холоду протекает реакция по уравнению:
3С2Н5ОН + 2K2Cr2O7 + 8H2SO4 → 3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
При нагревании:
3С2Н5ОН + K2Cr2O7 + 4H2SO4 → 3CH3COH + Cr2(SO4)3 + K2SO4 + 6H2O
2. Третичные спирты окисляются с трудом.
К реакциям окисления относятся и реакции дегидрирования:
СН3 -  - ОН
- ОН  СН3 -
СН3 -  = О + Н2
= О + Н2
3. Спирты горят: С2Н6О + 2О2 → 2СО2 + 3Н2О
VI. По радикалу (R) протекают реакции, характерные для соответствующих углеводородов (УВ). В случае предельных – SR, непредельных – АN, ароматических – SЕ:
1. Реакции по α- углеродному атому с галогенами:
СН3-СН2-ОН + 3Вr2  СВr3-СН2-ОН + 3НВr
СВr3-СН2-ОН + 3НВr
Этанол Нарколан
2. Реакции с галогенами в непредельных спиртах:
СН2 = СН-СН2-ОН + Вr2 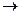 СН2 Вr–СНВr–СН2ОН
СН2 Вr–СНВr–СН2ОН
Аллиловый спирт 2,3- Дибромпропанол
3. Реакции по ароматическому кольцу:

Бензиловый спирт n-Нитрофенилметанол
Дата добавления: 2015-09-11; просмотров: 96 | Поможем написать вашу работу | Нарушение авторских прав |