
Читайте также:
|
Одним из важных законов термодинамики считается закон энтропии.
Понятие энтропии характеризует ту часть полной энергии системы, которая не может быть использована для производства работы. Поэтому в отличие от свободной энергии она представляет собой деградированную, отработанную энергию. Если обозначить свободную энергию через F, энтропию через S, то полная энергия системы Е будет равна Е = F+ ВТ, где Т – абсолютная температура по Кельвину.
Согласно второму закону термодинамики энтропия в замкнутой системе постоянно возрастает и в конечном счете стремится к своему максимальному значению. Следовательно, по степени возрастания энтропии можно судить об эволюции замкнутой системы, а тем самым и о времени ее изменения. Так впервые в физическую науку были введены понятия времени и эволюции, связанные с изменением систем. Но понятие эволюции в классической термодинамике рассматривается совсем иначе, чем в общепринятом смысле. Это стало вполне очевидным после того, когда немецкий ученый Л. Баяьцман(1844–1906) стал интерпретировать энтропию как меру беспорядка (хаоса) в системе.
Таким образом, второй закон термодинамики можно было теперь сформулировать так: замкнутая система, предоставленная самой себе, стремится к достижению наиболее вероятного состояния, заключающегося в ее максимальной дезорганизации. Хотя чисто формально дезорганизацию можно рассматривать как самоорганизацию с отрицательным знаком или самодезорганизацию, тем не менее, такой взгляд ничего общего не имеет с содержательной интерпретацией самоорганизации как процесса становления качественно нового, более высокого уровня развития системы. Но для этого необходимо было отказаться от таких далеко идущих абстракций, как изолированная система и равновесное состояние.
Между тем классическая термодинамика именно на них как раз и опиралась и поэтому рассматривала, например, частично открытые системы или находящиеся вблизи от точки термодинамического равновесия как вырожденные случаи изолированных равновесных систем.
Наиболее фундаментальным из таких понятий, как уже отмечалось выше, стало понятие открытой системы, которая способна обмениваться с окружающей средой веществом, энергией и информацией. Поскольку между веществом и энергией существует взаимосвязь, можно сказать, что система в ходе своей эволюции производит энтропию, которая, однако, не накапливается в ней, а удаляется и рассеивается в окружающей среде. Вместо нее из среды поступает свежая энергия и именно вследствие такого непрерывного обмена энтропия системы может не возрастать, а оставаться неизменной или даже уменьшаться. Отсюда становится ясным, что открытая система не может быть равновесной, потому ее функционирование требует непрерывного поступления энергии и вещества из внешней среды, вследствие чего неравновесие в системе усиливается. В конечном итоге прежняя структура разрушается. Между элементами системы возникают новые когерентные, или согласованные, отношения, которые приводят к кооперативным процессам. Так, схематически могут быть описаны процессы самоорганизации в открытых системах, которые связаны с диссипацией, или рассеянием, энтропии в окружающую среду.
Некоторые особенности термодинамики живых систем. Второе начало термодинамики устанавливает обратную зависимость энтропии и информации. Информация(I) является важным фактором эволюции биологических систем – это мера организованности системы, то есть упорядоченности расположения и движения её частиц. Информация выражается в битах, причём 1 бит информации эквивалентен 10-23 Дж/К (очень малой величине), но в любой системе имеет место закон сохранения: I + S = const
В биологических системах химические реакции протекают при постоянных объёме и давлении, поэтому, обозначив изменение общей энергии системы как D E, способность системы совершать полезную работу можно выразить уравнением:
 =
=  –
–  .
.
Это уравнение можно записать и в другой форме:
 =
=  +
+  ,
,
означающей, что общий запас энергии в системе расходуется на совершение полезной работы и на рассеяние её в виде теплоты.
Другими словами, и в биологической системе изменение общей энергии системы равно изменениям энтропии  и свободной энергии
и свободной энергии  .В системе при постоянных температуре и давлении самопроизвольно могут совершаться только такие процессы, в результате которых энергия Гиббса уменьшается. Самопроизвольный процесс приводит к состоянию равновесия при котором D G = 0. Из этого состояния без внешнего воздействия система выйти не может. Для живого организма состояние термодинамического равновесия означает его гибель. Поэтому для функционирующих открытых систем вводят представление о стационарном состоянии, для которого характерно постоянство параметров системы, неизменность во времени скоростей притока и удаления веществ и энергии.При этом открытая система в каждый данный момент не отвечает условиям стационарного состояния, только при рассмотрении среднего значения параметров открытой системы за сравнительно большой промежуток времени, установлено их относительное постоянство. Таким образом, открытая система в стационарном состоянии во многом сходна с системой, находящейся в термодинамическом равновесии – для них наблюдается неизменность свойств системы во времени (табл. 5).
.В системе при постоянных температуре и давлении самопроизвольно могут совершаться только такие процессы, в результате которых энергия Гиббса уменьшается. Самопроизвольный процесс приводит к состоянию равновесия при котором D G = 0. Из этого состояния без внешнего воздействия система выйти не может. Для живого организма состояние термодинамического равновесия означает его гибель. Поэтому для функционирующих открытых систем вводят представление о стационарном состоянии, для которого характерно постоянство параметров системы, неизменность во времени скоростей притока и удаления веществ и энергии.При этом открытая система в каждый данный момент не отвечает условиям стационарного состояния, только при рассмотрении среднего значения параметров открытой системы за сравнительно большой промежуток времени, установлено их относительное постоянство. Таким образом, открытая система в стационарном состоянии во многом сходна с системой, находящейся в термодинамическом равновесии – для них наблюдается неизменность свойств системы во времени (табл. 5).
Минимальное значение свободной энергии соответствует состоянию равновесия – стационарному состоянию.
Таблица 5
Свойства термодинамически равновесных и стационарных систем
| Состояние термодинамического равновесия | Стационарное состояние |
| 1. Отсутствие обмена с окружающей средой, веществом и энергией | 1. Непрерывный обмен с внешней средой, веществом и энергией |
| 2. Полное отсутствие в системе каких-либо градиентов | 2. Наличие постоянных по величине градиентов |
| 3. Энтропия системы постоянна и соответствует максимальному в данных условиях значению | 3. Энтропия системы постоянна, но не соответствует максимальному в данных условиях значению |
| 4. Изменение энергии Гиббса равно нулю | 4. Для поддержания стационарного состояния необходимы постоянные затраты энергии Гиббса |
| 5. Система нереакционноспособная и не совершает работу против внешних воздействий. Скорости процессов, протекающих в противоположных направлениях равны | 5. Реакционноспособность (работоспособность) системы постоянна и не равна нулю. Скорость процесса в одном из направлений больше, чем в другом |

| Зависимость между изменениями свободной энергии и изменениями энтропии в системе и окружающей среде в условиях постоянства температуры и давления показана на рис. 8. Если система (в том числе живой организм) претерпевает какие-либо превращения, ведущие к установлению равновесия, то общая энергия системы и окружающей среды остаётся постоянной, а общая энергия самой системы может либо уменьшаться, либо оставаться неизменной, либо увеличиваться. В ходе этих превращений система либо отдаёт тепло внешней среде, либо поглощает извне. Общая энтропия системы и окружающей среды будет увеличиваться до тех пор, пока не будет, достигнут максимум, соответствующий состоянию равновесия. Стремление энтропии к максимуму является истинной движущей силой любых процессов. Однако это не означает, что все процессы, ведущие к установлению равновесия должны сопровождаться увеличением энтропии самой системы. Энтропия самой системы может увеличиваться, уменьшаться или оставаться неизменной. Если энтропия системы уменьшается, то, согласно второму закону термодинамики, энтропия окружающей среды должна увеличиваться таким образом, чтобы общая энтропия системы и окружающей среды увеличивалась. Именно это и происходит, когда растёт живой организм: энтропия организма (как системы) уменьшается, а энтропия окружающей среды увеличивается. Математическими выражениями второго начала термодинамики для открытых систем являются: | |
| Рис. 8. Возможные изменения свободной энергии и энтропии рассматриваемой системы и окружающей среды, когда температура, давление и объём системы постоянны. |
 ,
,
где  – общее изменение энтропии системы за промежуток времени
– общее изменение энтропии системы за промежуток времени  ;
;  – производство энтропии внутри системы, обусловленное протеканием в ней необратимых процессов (например, деструкция сложных молекул пищевых веществ и образование большого числа более простых молекул);
– производство энтропии внутри системы, обусловленное протеканием в ней необратимых процессов (например, деструкция сложных молекул пищевых веществ и образование большого числа более простых молекул);  – изменение энтропии, обусловленное взаимодействием открытой системы с окружающей средой;
– изменение энтропии, обусловленное взаимодействием открытой системы с окружающей средой;
 ,
,
где  – изменение энергии Гиббса, противоположное по знаку изменению энтропии;
– изменение энергии Гиббса, противоположное по знаку изменению энтропии;  – изменение энергии Гиббса внутри системы;
– изменение энергии Гиббса внутри системы;  – разница между изменением энергии Гиббса внутри системы и внешней среде.
– разница между изменением энергии Гиббса внутри системы и внешней среде.
В стационарном состоянии 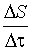 = 0 и
= 0 и  = 0, следовательно,
= 0, следовательно,  =
=  ,
,  =
=  , т. е. производство энтропии внутри системы компенсируется отдачей ее в окружающую среду, а убыль энергии Гиббса в связи с протеканием необратимых процессов восполняется за счет поступления энергии из внешней среды.
, т. е. производство энтропии внутри системы компенсируется отдачей ее в окружающую среду, а убыль энергии Гиббса в связи с протеканием необратимых процессов восполняется за счет поступления энергии из внешней среды.
Одна из основных теорем термодинамики открытых систем (И. Пригожин, 1946): в стационарной термодинамически открытой системе скорость производства энтропии, обусловленного протеканием в ней необратимых процессов принимает минимальное для данных условий положительное значение  ® 0.
® 0.
Поскольку энтропия является мерой деградации или рассеяния энергии, теорема Пригожина приводит к важнейшему заключению – при стационарном состоянии рассеяние энергии Гиббса открытой системой оказывается минимальным. Живой организм, представляющий открытую систему, поставлен природой в выгодные с точки зрения энергообеспечения условия: поддержание относительного постоянства его внутренней среды, называемого в биологии гомеостазисом требует минимального потребления энергии Гиббса.
Таким образом, живой организм – это открытая система, обменивающаяся с окружающей средой энергией, материей и информацией Жизнедеятельность биологических объектов показывает, что они «не хотят» подчинятся законам линейной термодинамики для изолированных систем, для которых устойчивым является равновесное состояние с минимумом свободной энергии и максимумом энтропии.
Многие системы неживой и особенно живой природы требуют принципиально другого подхода – как к сложным самоорганизующимся объектам, в которых идут неравновесные нелинейные процессы когерентного характера. Физику живого можно рассматривать как феномен пост - неклассической физики. С возникновением теоретической базы биологии, развитием молекулярной биологии и генетики удаётся объяснить механизмы организации живого, передачи генетического кода, синтеза ДНК, аминокислот, белкови других важных для жизни молекулярных соединений физико-химическими причинами.
Дата добавления: 2015-02-16; просмотров: 232 | Поможем написать вашу работу | Нарушение авторских прав |