
Читайте также:
|
Наиболее важные понятия термодинамики - «теплота процесса» и «работа». Преобразование теплоты в работу или работы в теплоту осуществляется обычно в термодинамическом процессе посредством рабочего тела. Термодинамическая система называется однородной, если во всех частях системы свойства одинаковы. Совокупность физических свойств рабочего тела (или термодинамической системы) в рассматриваемых условиях называется состоянием тела (или системы). Величины, характеризующие состояние термодинамической системы, называют термодинамическими параметрами. К ним относят температуру, давление, удельный объем, плотность, молярный объем, удельную внутреннюю энергию и др.
Термодинамические параметры делят на экстенсивные и интенсивные. Величины, пропорциональные массе (или количеству вещества) рассматриваемого рабочего тела или термодинамической системы, называются экстенсивными это – объем, внутренняя энергия, энтальпия, энтропия и т. п. Экстенсивные параметры обладают свойством аддитивности. Интенсивные величины не зависят от массы термодинамической системы, и только они служат термодинамическими параметрами состояния. Это – температура, давление, а также экстенсивные величины, отнесенные к единице массы, объема или количества вещества. Изменение интенсивных параметров для ускорения химико-технологических процессов называется интенсификацией.
Под воздействием подвода или отвода энергии в форме теплоты или работы происходит изменение состояния термодинамической системы (значений термодинамических параметров), называемое термодинамическим процессом. Процессы, представляющие собой непрерывный ряд равновесных состояний, называют равновесными. При этом равновесным считают состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты.
Устойчивое равновесие характеризуется следующими общими условиями:
1) неизменностью равновесного состояния системы во времени при постоянных внешних условиях;
2) подвижностью равновесия (самопроизвольным восстановлением состояния равновесия после снятия внешнего воздействия, вызвавшего отклонение системы от положения равновесия);
3) динамическим характером равновесия, т.е. установлением и сохранением равновесия вследствие равенства скоростей прямого и обратного процессов; 4) возможностью подхода к состоянию равновесия с двух противоположных сторон;
5) минимальным значением энергии Гиббса G в изобарно-изотермических и энергии Гельмгольца F в изохорно-изотермических процессах.
Изобарный и изохорный потенциалы.
Мы разобрали такие понятия как энтальпия, изобарная и изохорная теплоемкость, введением энтропии был завершен ряд термодинамических функций, необходимых для расчетов. Однако удобно ввести еще три функции: G, F и μ, которые обладают весьма полезными свойствами. Энтропия S дает критерий равновесия для изолированной системы, изобарный потенциал G – для системы при постоянных температуре и давлении, изохорный потенциал F – при постоянных температуре и объеме, химический потенциал μ является интенсивной величиной, определяющей направление химического или физического процесса.
Изобарный потенциал G (энергия Гиббса) определяется через другие термодинамические функции соотношением
G = H – TS = U + PV – TS (5.25)
Изменение изобарного потенциала при переходе из состояния 1 в состояние 2 равно:
G2 – G1 = (U2 – U1) + (P2V2 – P1V1) – (T2S2-T1S1)
ΔG = ΔU + Δ(PV) – Δ(TS) = ΔH – Δ(TS) (5.26)
При постоянных давлении и температуре
ΔG = ΔU + PΔV – TΔS (5.27)
Из курса термодинамики известно, что изменение внутренней энергии системы равно количеству теплоты подведенной к системе, за вычетом работы совершенной системой или ΔU = q – A. Следовательно, получим
ΔG = ΔU = q – A + PΔV – TΔS (5.28)
Если процесс проводится обратимо и теплота q переносится от тела с бесконечной теплоемкостью, и имеющего температуру Т, одинаковую с температурой системы, то q = TΔS и работа А = Аобр. Тогда можно записать
- ΔG = Аобр – PΔV (5.29)
Таким образом, когда процесс происходит обратимо при постоянных температуре и давлении уменьшение термодинамического потенциала равно максимальной работе Аобр за вычетом работы расширения PΔV.
Если процесс проводится обратимо и теплота q переносится от тела с бесконечной теплоемкостью, и имеющего температуру Т, одинаковую с температурой системы, то TΔS > q. Подстановка в уравнение (5.28) показывает, что
- ΔG > Аобр – PΔV (5.30)
Таким образом, для необратимого процесса при постоянных температуре и давлении уменьшение изобарного потенциала больше, чем максимальная работа, которая может быть получена помимо работы расширения.
Изохорный потенциал F определяется через другие термодинамические функции следующим образом:
F = U – TS или ΔF = ΔU – Δ(TS) (5.31)
Полагая температуру Т постоянной и подставляя в уравнение (5.31) уравнение изменения внутренней энергии, можно показать, что
- ΔF = Аобр (5.32)
Таким образом, уменьшение изохорного потенциала равно максимальной работе, которую можно получить при изотермическом процессе.
Независимо от обратимости или необратимости данного процесса функция F изменяется на одну и ту же величину. Однако для того чтобы определить уменьшение функции F для данного процесса, необходимо измерить работу обратимого процесса.
Критерии химического равновесия.
Пытаясь найти термодинамический критерий самопроизвольности химических реакций Бертело в 1879 г. пришел к неправильному выводу, что самопроизвольны лишь те реакции, при которых выделяется тепло. Открытие самопроизвольных реакций, при которых тепло поглощается, доказало неправильность этого заключения. Можно показать, что изотермический процесс при постоянном давлении протекает самопроизвольно, если G уменьшается; изотермический же процесс при постоянном объеме протекает самопроизвольно, если уменьшается F.
Для практических целей весьма важно знать – в равновесном или только в метастабильном состоянии находится система. Под равновесным, мы имеем в виду такое состояние, в котором система не может подвергаться самопроизвольным изменениям. Иными словами, при равновесии любое бесконечно малое изменение в системе должно быть обратимым, так как любое необратимое изменение привело бы к смещению первоначального равновесия.
Рассмотрим систему, находящуюся в контакте с тепловым резервуаром при температуре Т, в которой происходит бесконечно малое необратимое изменение и совершается только работа расширения, δq – количество теплоты, которой система обменивается с резервуаром. Ввиду того что процесс необратим, dS для системы больше, чем δq/Т, как это было показано ранее, т. е.
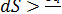
Так как TdS больше, чем δq, то разность:
 (5.33)
(5.33)
Поскольку производится только работа расширения, постольку δq = dU + PdV. Подставляя это выражение в уравнение (5.33), получим
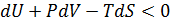 (5.34)
(5.34)
Это неравенство справедливо во всех случаях, когда совершается только работа расширения. Если объем и энтропия системы постоянны, то
 (5.35)
(5.35)
Следовательно, в системе при постоянном объеме для любого необратимого процесса, происходящего без изменения энтропии, внутренняя энергия уменьшается. Это соответствует обычному условию, что для консервативной механической системы стабильным является состояние с наименьшей энергией.
Если в ходе бесконечно малого необратимого изменения объем и внутреннюю энергию системы поддерживать постоянными, то неравенство (5.34) переходит в
 (5.36)
(5.36)
Объем и внутреннюю энергию системы можно поддерживать постоянными путем изолирования системы. Таким образом, как было сказано ранее, энтропия при необратимых процессах в изолированной системе увеличивается. Следует помнить, что неравенства (5.34), (5.35) и (5.36) применимы лишь к системам, в которых совершается только работа расширения.
Если система незамкнута (открытая), то необходимо рассматривать изменение энтропии в контактирующих с ней системах. Эти добавочные изменения энтропии учитываются автоматически, когда функции F и G применяются в соответствующих условиях.
Если во время бесконечно малых изменений объем постоянен, то неравенство (5.34) принимает вид:
 (5.37)
(5.37)
 (5.38)
(5.38)
Подставляя F = U – TS, получаем
 (5.39)
(5.39)
Таким образом, в необратимом процессе при постоянных Т u V изохорный потенциал F уменьшается.
Обычно в лаборатории физические процессы и химические реакции проводят при постоянных давлении и температуре. Когда Р и Т постоянны, неравенство (5.34) принимает вид:
 (5.40) Вводя G = U + PV - TS, получим
(5.40) Вводя G = U + PV - TS, получим
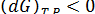 (5.41)
(5.41)
Таким образом, в случае необратимого процесса при постоянных Т и Р, если совершается только работа расширения, изобарный потенциал G уменьшается.
Если рассматривавшиеся выше процессы обратимы, то все знаки неравенства нужно заменить знаками равенства в соответствии с уравнением (5.1). Условия для необратимости и обратимости процессов, в которых совершается только работа расширения, даны в таблице.
Дата добавления: 2015-04-20; просмотров: 73 | Поможем написать вашу работу | Нарушение авторских прав |
|