
Читайте также:
|
| Для обратимых процессов | Для необратимых процессов | Для обратимых процессов | Для необратимых процессов |

| 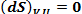
| 
| 
|

| 
| 
| 
|
Каждая строка в таблице представляет собой математическую формулировку второго закона термодинамики. Так как изобарный потенциал в необратимом процессе при постоянных Т и Р уменьшается, то в конечном равновесном состоянии он становится минимальным, т. е. dG = 0 для любого бесконечно малого изменения. Мы можем представить себе процесс, протекающий при равновесии. Например, можно представить испарение бесконечно малого количества воды, находящейся в равновесии с насыщенным паром при постоянных температуре и давлении. Для такого процесса dG = 0.
Те же самые соотношения могут применяться не только к бесконечно малым, но и к конечным изменениям, при этом d заменяется на Δ. Однако следует помнить, что самопроизвольные процессы всегда приводят к минимуму (в случае изобарного потенциала при постоянных Т и Р) или к максимуму (вслучае энтропии S изолированной системы) функции, а не к какому-нибудь другому ее значению, даже если переход к этому новому значению удовлетворял бы соответствующему неравенству.
Приведенные рассуждения ограничивались системами, которые не имели возможности совершать какую-либо другую работу, кроме работы расширения. Если система включает в себя гальванический элемент, то может производиться электрическая работа, и критерий равновесия следует изменить.
Хотя эти критерии показывают, является ли некоторый процесс самопроизвольным, однако они не дают еще основания сделать вывод о том, что изменения будут происходить с заметной скоростью.
Например, смесь 1 моль углерода с 1 моль кислорода при 1 атм и 25°С имеет больший изобарный потенциал, чем 1 моль двуокиси углерода при 1 атм и 25°С; следовательно, имеется возможность образования двуокиси углерода из углерода и кислорода при данных постоянных температуре и давлении. Эта реакция теоретически возможна, хотя углерод может существовать в контакте с кислородом очень долгое время. Процесс, обратный самопроизвольному, конечно, является несамопроизвольным. Так, разложение двуокиси углерода при комнатной температуре, сопровождающееся увеличением изобарного потенциала, - несамопроизвольный процесс. Он может происходить только под внешним воздействием, например при нагревании до очень высокой температуры, при которой изменение изобарного потенциала поменяет знак на противоположный.
Изобарный потенциал как критерий равновесия.
Рассмотрение изобарного потенциала как критерия равновесия или самопроизвольности процесса при постоянных температуре и давлении можно пояснить на примере смеси льда и воды. И лед, и вода имеют одинаковый мольный изобарный потенциал при 0° и 1 атм. В этих условиях лед не плавится, а вода не замерзает ΔG = 0. С другой стороны, мольный изобарный потенциал для воды, переохлажденной до -10°С, больше, чем для льда при -10°С (давление 1 атм). Переход воды в лед в этих условиях сопровождается изменением изобарного потенциала и, следовательно, является самопроизвольным переходом ΔG < 0. Переход в обратном направлении, т. е. превращение льда в воду при -10°, не может протекать самопроизвольно, потому что он сопровождался бы увеличением изобарного потенциала, т. е. ΔG > 0.
Для изотермического процесса получим изменение термодинамического потенциала из уравнения (5.26):
ΔG = ΔH – TΔS (5.42)
Это очень важное уравнение. ΔH и ΔS можно определять прямыми калориметрическими измерениями, азатем рассчитывать ΔG. Изменение изобарного потенциала используется в расчетах электродвижущих сил электрохимических элементов и констант равновесия химических реакций.
При постоянных температуре и давлении положение равновесия определяется двумя противоположными тенденциями:
во-первых, происходит максимально возможное уменьшение энергии,
во-вторых, максимально возможно увеличивается энтропия.
Поскольку функция G в положении равновесия при постоянных температуре и давлении минимальна, то разность H - TS также должна быть минимальной при равновесии.
При смешении двух идеальных газов ΔH = 0, при этом изменение изобарного потенциала можно рассчитать из уравнений (5,42) и (5.17):
Δ G = RT∙(X1lnX1 + X2lnX2) (5.43)
Вследствие того, что Xi < 1, очевидно, что величина Δ G при смешении идеальных газов при постоянных температуре и давлении всегда отрицательна.
Дата добавления: 2015-04-20; просмотров: 80 | Поможем написать вашу работу | Нарушение авторских прав |