
Читайте также:
|
При каталитическом гидрировании (восстановлении) фенола образуется циклогексанол:

Циклогексанол является исходным продуктом в синтезе капрона и нейлона. Цинковая пыль может восстановить фенол даже до циклогексана:

Фенолы легко окисляются даже кислородом воздуха. Наличие примесей приводит к ускорению окисления. Окисленный фенол краснорозового цвета, очищенный — бесцветный.

Фенолы, в зависимости от природы окислителя, могут образовывать разные продукты.
В щелочной среде фенолы окисляются в большей степени, чем в нейтральной, это связано с образованием феноксид-иона. В результате сопряжения увеличивается электронная плотность на бензольном ядре, и оно становится еще более чувствительным к действию окислителей.
При окислении фенола персульфатом калия K2S2O8 в щелочной среде образуется гидрохинон (реакция Эльбса):

ДВУХ- И ТРЕХАТОМНЫЕ ФЕНОЛЫ
Двухатомные фенолы содержат в своей структуре две группы ОН, трехатомные — три группы ОН.

Способы получения
Двухатомные фенолы получают теми же способами, что и одноатомные, но используют для этой цели дизамещенные производные бензола.
1. Сплавление натриевых солей арендисульфокислот со щелочами:
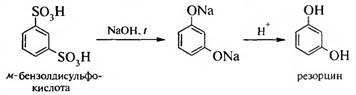
Этим способом чаше всего получают резорцин.
2. Взаимодействие галогенозамещенных фенолов шш дигалогенпро- изводных бензола со щелочами:

Эта реакция применяется для получения пирокатехина.
3. Восстановление хинонов:

|
Химические свойства
Для многоатомных фенолов характерны те же реакции, что и для одноатомных.
Они могут галогенироваться, нитроваться, сульфироваться.
С увеличением числа ОН-групп в молекуле усиливаются кислотные свойства по сравнению с фенолом. Но несмотря на это, кислотные свойства двух- и трехатомных фенолов остаются слабее по сравнению с угольной кислотой.
Двухатомные фенолы образуют соли не только со щелочами, но и с тяжелыми металлами:

При окислении пирокатехина и гидрохинона образуются соответствующие о- и п-хиноны.
Важнейшие представители многоатомных фенолов
ГИДРОХИНОН (п-дигидроксибензол). Является сильным восстановителем, очень легко окисляется, в том числе и раствором FeCl3

В результате окисления образуется п-хинон.
Гидрохинон применяется как проявитель в фотографии. Встречается в природе в виде гликозида арбутина, который содержится в растении толокнянка.
ПИРОКАТЕХИН (о-дигидроксибензол) легко окисляется, являясь хорошим восстановителем. Восстанавливает аммиачный раствор Ag20, при нагревании восстанавливает раствор Фелинга:

Монометиловый эфир пирокатехина — гваякол применяется в синтезе ванилина (4-гидрокси-З-метоксибензальдегида), ароматических и лекарственных веществ.
РЕЗОРЦИН (м -дигидроксибензол). Кристаллическое вещество, хо- рошо растворяется в воде, tпл110 °С.

Применяется в аналитической практике в растворе НС1 как реактив на кетозы (проба Селиванова). Применяется в производстве красителей и резорцин-формальдегидныхсмол. Является медицинским препаратом, используется в мазях как антисептическое средство.
ПИРОГАЛЛОЛ (1,2,3-тригидроксибензол) (от слова «пирос» — огонь).
Белое кристаллическое вещество с tпл 134 °С, растворяется в воде и спиртах.

Получают при декарбоксилировании галловой кислоты:

Пирогаллол является сильным восстановителем. Серебряные соли пирогаллола легко восстанавливаются до металлического серебра, поэтому он используется в фотографии. Щелочные растворы пирогаллола хорошо поглощают кислород, что используется для количественного определения его содержания в газовой смеси.
ФЛОРОГЛЮЦИН (1,3,5-тригидроксибензол). Кристаллическое вещество с tпл 223 °С, возгоняется, растворимое в спиртах и плохо — в воде.
Получают при нагревании водных растворов 1,3.5-триаминобензола в кислой среде.

Для флороглюцина возможна кето-енольная таутомерия:

Наличие гидроксильных групп доказывают реакцией с FeCl3 (образуется темно-фиолетовое окрашивание). Наличие кетогрупп подтверждают реакци-ей с NH2OH с образованием триоксима.
Флороглюцин используется в аналитической практике для количественного определения пентоз. При нагревании пентоз образуется фурфурол, который с флороглюцином дает окрашенный продукт конденсации.
Дата добавления: 2015-09-11; просмотров: 294 | Поможем написать вашу работу | Нарушение авторских прав |