
Читайте также:
|
Химические методы идентификации спиртов
Качественный анализ гидроксильных групп. Существует множество относительно простых тестов, позволяющих выявить в органическом соединении наличие гидроксильного фрагмента (−OH), однако все они имеют довольно ограниченное применение и не являются универсальными: часто присутствие прочих функциональных групп или кратных связей в веществе могут либо не проявить искомые свойства спирта, либо дать ложно положительный эффект на ту или иную реакцию.
Наиболее известные качественные реакции на спирты:
· Проба Лукаса: при реакции вторичного или третичного спирта при комнатной температуре (первичные спирты в реакцию, как правило, не вступают) с реактивом Лукаса (смесь концентрированной соляной кислоты и хлорида цинка) происходит образование галогенопроизводного, которое распознаётся по образованию характерного масла, образующего отдельную от исходного спирта фазу. При этом зафиксировав время реакции, можно различить вторичные (эффект наблюдается по истечение 5-ти минут) и третичные спирты (реакция протекает практически мгновенно или в течение не более 3-х минут)

Некоторые первичные спирты, например: аллиловый или бензиловый, дают положительную реакцию с реактивом Лукаса.

Положительная (справа) и отрицательная проба Лукаса
· Иодоформная проба: предназначена для идентификации спиртов вида R−CH(OH)−CH3 и кетонов вида R−C(O)−CH3

Идентификацию спиртов осуществляют по характерному жёлтому осадку иодоформа, обладающего специфическим запахом.
· Тест Виктора Мейера: позволяет дифференцировать первичные, вторичные и третичные спирты по реакции получаемых из них нитропроизводных с азотистой кислотой. На первой стадии спирты трансформируются в галогенопроизводные, которые, в свою очередь, превращаются в нитроалканы


Далее взаимодействие с HNO2 делает возможными три варианта развития событий

раствор окрашивается в красный цвет (натриевая соль нитроловой кислоты — RC(NO2)=NONa)

раствор окрашивается в синий цвет

раствор остаётся бесцветным (реакция не идёт).
· Цератная проба: при взаимодействии спиртов с азотнокислым раствором гексанитратоцерата(IV) аммония, имеющим жёлтую окраску, образуются переходные комплексы красного цвета, которые затем обесцвечиваются вследствие окисления спирта и перехода Ce(IV) в анион Ce(III). Для спиртов, нерастворимых в воде, используют растворы в диоксане или ацетонитриле

· Окислительная проба: при взаимодействии первичных или вторичных спиртов с реактивом Джонса (раствор оксида хрома (VI) в серной кислоте), имеющим оранжевую окраску, образуются продукты окисления (карбоновые кислоты или кетоны), а сам реактив меняет цвет на зелёный или голубой благодаря солям восстановленного хрома (III). Важной особенностью теста является время фиксации изменения окраски — 2 секунды, по истечении которого любые дальнейшие изменения в структуре или цвете раствора не принимаются во внимание
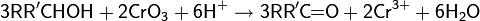
· Сульфидная проба: вторичные спирты при нагревании с серой образуют сероводород, который идентифицируется по образованию чёрного осадка с ацетатом свинца


Реагенты для химической идентификации спиртов
Идентификацию конкретного спирта (наряду с другими методами) осуществляют по его производным, образующимся в результате его химического взаимодействия с различными реагентами: измеряя основные физические параметры получившегося производного (температура плавления, температура кипения и пр.) можно c различной степенью достоверности подтвердить формулу исходного соединения.
Количественный анализ спиртов
Для количественного анализа спиртов, обычно, используют методы, основанные на реакции этерификации (реакция 1), реже — на определении активного водорода (реакция 2). Для гликолей также применим окислительно-восстановительный метод, где в качестве окислителя используется иодная кислота (реакция 3)



Для этерификации чаще всего применяют уксусный и фталевый ангидриды, а также пиромеллитовый диангидрид. Содержание спирта определяется титрованием образующейся в результате реакции кислоты гидроксидом натрия. В случае гликолей анализ проводят по реакции образующейся иодноватой кислоты (HIO3) с иодидом калия и последующим титрованием выделившегося иода тиосульфатом натрия


Наконец, анализ на определении активного водорода сводится к анализу выделившегося в ходе реакции метана (метод Чугаева — Церевитинова).
Спектральные методы анализа спиртов
Масс-спектрометрические методы анализа спиртов. Масс-спектры алифатических спиртов имеют слабые M+ сигналы, а для высших и сильноразветвлённых соединений практически отсутствуют, поэтому для алканолов рассматривают характеристические распады с образованием оксониевых ионов или элиминирование с образованием алкенов.
Для первичных спиртов — m/z 31, для вторичных — m/z 45, 59, 73 …, для третичных — m/z 59, 73, 87 …
Характеристические пики, связанные с элиминированием воды и алкена: [M-46]+, [M-74]+, [M-102]+…
ИК-спектроскопические методы анализа спиртов. ИК-спектры спиртов характеризуются двумя типами интенсивных характеристических полос поглощения:
· полосы поглощения, связанные с валентными колебаниями O−H группы: 3650—3200 см−1;
· полосы поглощения, связанные с валентными колебаниями С−O−H группы: 1210—1000 см−1.
Также выделяют полосы поглощения средней интенсивности, как правило не имеющие определяющего значения: в диапазоне 1450—1250 см−1 (плоскостные деформационные колебания O−H группы) и 750—650 см−1 (внеплоскостные деформационные колебания O−H группы).
При анализе ИК-спектров необходимо учитывать, что некоторые функциональные группы дают характеристические полосы в диапазонах, близких или совпадающих с диапазонами спиртов: валентные колебания O−H группы сходны с валентными колебаниями связей N-H, C-H алкинов и воды; валентные колебания связи C−O сходны с валентными колебаниями связей C−F, C−N, N−O, P−O, C=S, S=O, P=O, Si−O, Si-H.
ЯМР-спектроскопические методы анализа спиртов
ЯМР-спектроскопические методы для ядер 1H широко используются для анализа спиртов, однако на положение сигнала существенно влияет природа растворителя и другие внешние факторы, поэтому величины характеристических сдвигов протонов (δ, м. д. относительно тетраметилсилана) рассматривают либо для чистых веществ (если соединение не содержит несколько типов подвижных атомов H), либо для их растворов в диметилсульфоксиде (ДМСО) или трихлордейтерометане (CDCl3). Для алифатических и алициклических спиртов δ: 0,5—3,0 (в ДМСО: 4—6). Химические сдвиги ядер 13С в спиртах (δ, м. д. относительно тетраметилсилана) составляют диапазон 50—100 (смещение примерно 50 м.д. по сравнению с сигналом C−H).
Также для изучения гидроксильных соединений применяют импульсную Фурье-спектроскопию на ядрах 17O. Значительная разница в сдвигах для первичных (этанол: δ=5,9 м. д.), вторичных (изопропанол: δ=39,8 м. д.) и третичных спиртов (трет -бутанол: δ=62,3 м д.) относительно воды H217O позволяет установить или подтвердить структуру исследуемого соединения.
Дата добавления: 2015-09-11; просмотров: 204 | Поможем написать вашу работу | Нарушение авторских прав |