
Читайте также:
|
Физико-химические свойства спиртов определяются в основном строением углеводородной цепи и функциональной группы −OH, а также их взаимным влиянием:
1) чем больше заместитель, тем сильнее он влияет на функциональную группу, снижая полярность связи O—Н. Реакции, основанные на разрыве этой связи, протекают более медленно;
2) гидроксильная группа −ОН уменьшает электронную плотность вдоль прилегающих σ-связей углеродной цепи (отрицательный индуктивный эффект).
Все химические реакции спиртов можно разделить на три условных группы, связанных с определёнными реакционными центрами и химическими связями:
· разрыв связи O−H (реакционный центр — водород);
· разрыв или присоединение по связи С−OH (реакционный центр — кислород);
· разрыв связи −СOH (реакционный центр — углерод).
Реакции с участием гидроксильной группы (связи С−O и О−H)
Кислотно-основные реакции спиртов
Со щелочными и щелочноземельными металлами, алюминием, галлием, таллием и некоторыми другими металлами, а также сильными основаниями (например: амидами или гидридами) спирты способны реагировать с образованием алкоголятов


С сильными кислотами Льюиса спирты ведут себя подобно основаниям, образуя донорно-акцепторные комплексы
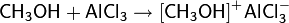
Превращение спиртов в галогеналканы
Одной из наиболее важных реакций с участием связи C−O является превращение спиртов в галогеноалканы. Гидроксильная группа в спиртах может быть замещена на атом галогена несколькими способами:
· взаимодействием с галогенводородами (HCl, HBr, HI);
· реакцией с тионилхлоридом;
· действием галогенидов фосфора (III) и (V);
· реакцией с квазифосфониевыми солями;
· превращением в алкилсульфонат с последующей реакцией замещения.
Взаимодействие спиртов с галогенводородами
Взаимодействие спиртов с галогенводородными кислотами приводит к замещению гидроксильной группы на галоген

В зависимости от строения субстрата возможны побочные процессы изомеризации и дегидратации. Из-за относительно жестких условий проведения данные реакции применимы только к соединениям, устойчивым к кислотам.
Бромоводородную и иодоводородную кислоты часто получают непосредственно в ходе реакции из соответствующих солей (KBr, KI и т.д.) действием серной или фосфорной кислот. Незамещенные первичные спирты превращаются в алкилбромиды с помощью горячей концентрированной бромоводородной кислоты

Попытки получить алкилиодид с помощью HI иногда могут приводить к восстановлению первоначального продукта до алкана. Помимо этого, свободный иодоводород способен реагировать с серной кислотой, приводя к образованию сернистой кислоты и иода. Если субстрат содержит двойные связи, последние также могут быть восстановлены

Вышеуказанные реакции можно использовать для получения первичных, вторичных и третичных галогеноалканов, хотя в случае изобутилового и неопентилового спиртов велики выходы продуктов перегруппировки

Реакции третичных спиртов с HCl протекают достаточно легко. При этом образуются соответствующие третичные алкилхлориды (совместно с продуктами побочных реакций). Первичные и вторичные спирты реагируют гораздо медленнее и требуют применения катализатора. Обычно используется так называемый реагент Лукаса, представляющий собой смесь HCl и ZnCl2

Хорошие выходы первичных алкилхлоридов были также получены при использовании HCl в HMPA (гексаметилфосфотриамид, биполярный апротонный растворитель).
Прямое взаимодействие спиртов с фтороводородом возможно только при использовании третичных, аллиловых и бензиловых спиртов. Так, например, реакция трет -бутилового спирта c 60 % водным раствором HF при нагревании приводит к образованию трет -бутилфторида
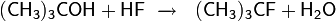
Вместо чистой HF для фторирования обычно используют 70 % раствор фтороводорода в пиридине, так называемый реактив Олаха. Первичные и вторичные спирты реагируют с галогенводородами по механизму SN2 (общая схема):
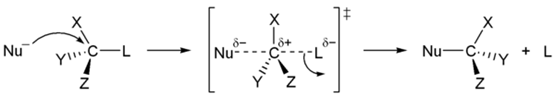
Для третичных спиртов характерен механизм SN1

В ходе такого замещения образуется промежуточный карбокатион, поэтому SN1 реакции могут сопровождаться перегруппировками и элиминированием. Таким образом, практический интерес представляют только те третичные спирты, которые дают карбокатион, не способный к перегруппировкам.
Взаимодействие спиртов с галогенидами фосфора
Распространённым способом превращения спиртов в алкилгалогениды является их взаимодействие с галогенидами фосфора: РВr3, РСl5, РОСl3 или РI3 (образуется непосредственно в ходе реакции). Реакция протекает по нуклеофильному механизму с образованием галогенфосфита в качестве интермедиата

Для повышения выхода конечного продукта и уменьшения доли побочных реакций замещение ведут в присутствии пиридина.
В соответствии с особенностями механизма реакции (SN2), замещение гидроксильной группы на галоген происходит с обращением конфигурации у асимметрического атома углерода. При этом следует учитывать, что замещение часто осложняется изомеризацией и перегруппировками, поэтому подобная реакция, обычно, применяется для относительно спиртов простого строения.
Взаимодействие спиртов с тионилхлоридом
В зависимости от условий взаимодействие спиртов с SOCl2 протекает либо по механизму SNi, либо по механизму SN2. В обоих случаях спирт превращается в соответствующий алкилхлорид.
Если реакция проходит в отсутствие пиридина, продукт имеет такую же конфигурацию реакционного центра, что и исходный спирт (механизм SNi)

Добавление пиридина в реакционную смесь приводит к изменению стереохимического результата процесса. Полученный алкилхлорид имеет обращенную конфигурацию. Этот факт можно объяснить следующим механизмом SN2

Взаимодействие спиртов с хлорангидридами сульфокислот и последующим замещением
Спирты способны реагировать с хлорангидридами сульфокислот в присутствии основания с образованием соответствующих сложных эфиров. Первичные спирты реагируют быстрее вторичных и значительно быстрее третичных. Возможно селективное образование первичного сложного эфира сульфокислоты в присутствии вторичных и третичных спиртовых групп. Наибольшее практическое значение имеет получение алкилтозилатов (R−O−SO2C6H4CH3), алкилмезилатов (R−O−SO2CH3) и алкилтрифлатов (R−O−SO2CF3). В роли основания чаще всего используется пиридин, который одновременно выступает и как нуклеофильный катализатор. Сульфонаты являются прекрасными уходящими группами и легко замещаются на атом галогена по механизму SN2

Источником галогенид-иона обычно является соответствующая неорганическая соль (NaBr, LiCl, CsF, KF] и т. д.) В качестве растворителя используются диполярные апротонные растворители: ДМСО, ДМФА, ацетонитрил. Замещение происходит, как правило, с обращением конфигурации.
Метод замещения гидроксила на высокореакционноспособную группу — мощный препаративный метод в органической химии, позволяющий получать из спиртов в две стадии, помимо галогенидов, самые различные соединения: простые эфиры, сложные эфиры карбоновых кислот, амиды.
Взаимодействие спиртов с квазифосфониевыми солями
Спирты могут быть превращены в алкилгалогениды реакцией с квазифосфониевыми солями — [R3PHal]+X−. Последние образуются при взаимодействии органофосфионов (R3P) с галогенами, тетрагалогенметанами (CCl4, CBr4) или N -галогенсукцинимидами (например, NBS). Данный метод применим к первичным и вторичным спиртам; в случае третичных спиртов возможно образование продуктов перегруппировки. R3PBr2 и R3PI2 (получаются из R3P и Br2/I2) дают хорошие выходы даже с третичными и неопентильными субстратами[96]. В общем виде реакция протекает по следующей схеме

Превращение происходит с инверсией реакционного атома углерода.
Частный случай взаимодействия — превращение спиртов в алкилхлориды под действием трифенилфосфина и тетрахлорметана — в заграничной литературе получил название реакции Аппеля (англ. Appel reaction)

Дата добавления: 2015-09-11; просмотров: 134 | Поможем написать вашу работу | Нарушение авторских прав |