
Читайте также:
|
Визначаючи зміну ентропії системи, можна, таким чином, дізнатися, чи буде дана реакція протікати спонтанно. Однак експериментальне визначення ентропії пов’язане з деякими серйозними труднощами. Судити про здатність системи до спонтанного руху по зміні її ентропії зручно лише при розгляді ізольованих систем, а також за тієї умови, що деякі інші параметри системи підтримуються при цьому незмінними. У тих же випадках, коли система обмінюється енергією з навколишнім її середовищем (тобто як в закритих, так і у відкритих системах), реакції можуть протікати мимовільно навіть при А5 менше нуля. У цих випадках»рушійною силою»процесу буде енергія, що надходить з навколишнього середовища. Тому для того, щоб дізнатися, чи буде цікавий для нас біологічний процес протікати спонтанно, нам необхідно визначити зміни ентропії, що відбуваються як у самій системі, так і в навколишньому її середовищі.
Дійсно, енергія може відбиратися з середовища або поглинатися нею (об’єднуючи закриту систему з навколишнім її середовищем, ми отримуємо за визначенням нову ізольовану систему). Це означає, що при такому розгляді саме поняття»система»служить для позначення істотно різних об’єктів, і тому треба весь час усвідомлювати, що ж мається на увазі під системою в кожен даний момент обговорення.
Отже, зміни ентропії per se занадто важко визначити таким чином, щоб це було зручно для практичного використання, і тому необхідно відшукати інший параметр, який дозволяв би одночасно врахувати зміни внутрішньої енергії та ентропії системи і в той же час визначався б експериментально з достатньою легкістю. Таким параметром є вільна енергія.
39. Ексергія — максимальна робота, яку може виконати термодинамічна система при переході від поточного стану до стану термодинамічної рівноваги.
Використання поняття ексергії дає можливість кількісно визначити вплив нерівноважності термодинамічних процесів на ефективність перетворення енергії, тобто дозволяє врахувати особливості другого закону термодинаміки: виділити ту частину енергії, яка не може бути використана через газодинамічні явища, тертя, теплообмін. Такий підхід дозволяє аналізувати ступінь термодинамічної досконалості того чи іншого елемента установки і не вимагає попередньої оцінки працездатності всієї установки в цілому
Втрати ексергії для теплообмінника:
П=(Егр1 — Егр2) — (Енагр1 — Енагр2), кДж
де: Егр1, Егр2 — ексергія потоку що гріє на вході та виході з теплообмінника, кДж.
Енагр1, Енагр2 — ексергія потоку що гріє на вході та виході з теплообмінника, кДж.
Ексергія потоку:
 , кДж,
, кДж,
де:  — ентальпія та ентропія потоку при його дійсних параметрах, кДж і кДж/К відповідно;
— ентальпія та ентропія потоку при його дійсних параметрах, кДж і кДж/К відповідно;  — ентальпія та ентропія потоку при температурі навколишнього середовища
— ентальпія та ентропія потоку при температурі навколишнього середовища  , кДж і кДж/К відповідно,
, кДж і кДж/К відповідно,  — температура навколишнього середовища, К.
— температура навколишнього середовища, К.
40. Теорема Нернста (тепловая теорема Нернста) — утверждение, являющееся одной из формулировок третьего начала термодинамики, сформулированное Вальтером Нернстом в 1906 году как обобщение экспериментальных данных по термодинамике гальванических элементов.
Теорема Нернста утверждает, что всякий термодинамический процесс, протекающий при фиксированной температуре  в сколь угодно близкой к нулю,
в сколь угодно близкой к нулю,  , не должен сопровождаться изменением энтропии
, не должен сопровождаться изменением энтропии  , то есть изотерма
, то есть изотерма 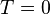 совпадает с предельной адиабатой
совпадает с предельной адиабатой  .
.
Существует несколько формулировок теоремы, которые эквивалентны между собой:
· Энтропия  любой системы при абсолютном нуле температуры:
любой системы при абсолютном нуле температуры: 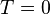 , является универсальной постоянной
, является универсальной постоянной  , не зависящей ни от каких переменных параметров (давления, объема и т. п.).
, не зависящей ни от каких переменных параметров (давления, объема и т. п.).
· При приближении к абсолютному нулю,  , энтропия S стремится к определенному конечному пределу
, энтропия S стремится к определенному конечному пределу  , не зависящему от конечного состояния системы.
, не зависящему от конечного состояния системы.
· При приближении к абсолютному нулю,  , приращение энтропии
, приращение энтропии  не зависит от конкретных значений термодинамических параметров состояния системы и стремится к вполне определенному конечному пределу.
не зависит от конкретных значений термодинамических параметров состояния системы и стремится к вполне определенному конечному пределу.
· Все процессы при абсолютном нуле, 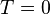 , при которых система переходит из одного равновесного состояния в другое, происходят без изменения энтропии.
, при которых система переходит из одного равновесного состояния в другое, происходят без изменения энтропии.
40.Теплова теорема Нернста.
41.Теплові двигуни.
Дата добавления: 2015-09-11; просмотров: 127 | Поможем написать вашу работу | Нарушение авторских прав |