
Читайте также:
|
1.В солнечной атмосфере содержится 82% водорода-1 и 18% гелия-4 (по числу атомов).
Рассчитайте массовую долю атомарного водорода в атмосфере Солнца. (Ответ: 53% водорода)
2.При пропускании 2 л воздуха (н.У.) через склянку с концентрированной серной кислотой масса склянки увеличилась на 0,2 г. Вычислите массовую долю водяных паров в воздухе? (Ответ: 7,7% Н2О)
3.Найдите молярную концентрацию 30% серной кислоты (плотностью раствора 1,22 г/мл). (Ответ: 3,73 моль/л)
4.Смешали 4 л кислорода и 6 л азота при н.у.. Состав смеси в объемных и массовых долях соответственно равен? (Ответ: 40 и 60%; 43,2 и 56,8%)
5.Плотность по водороду пропан-бутановой смеси равна 23,5. Состав смеси (% объемн.) для пропана и бутана соответственно равны? (Ответ: 78,6 и 21,4)
ТЕМА 2. ГАЗОВЫЕ ЗАКОНЫ В УРАВНЕНИЯХ РЕАКЦИЙ. (3 часа)
Основные понятия, законы и формулы: закон сохранения массы веществ, закон Авогадро и следствия из него, нормальные условия, идеальный газ, закон Бойля-Мариотта, закон Гей-Люссака, закон Шарля, уравнение Менделеева-Клайперона.
 Давление и объем образца газа обратно пропорциональны, т. е. их произведения являются постоянной величиной: pV = const. Это соотношение может быть записано в более удобном для решения задач виде:
Давление и объем образца газа обратно пропорциональны, т. е. их произведения являются постоянной величиной: pV = const. Это соотношение может быть записано в более удобном для решения задач виде:
p 1 V 1 = p 2 V2 (закон Бойля-Мариотта).
Представим себе, что 50 л газа (V 1 ), находящегося под давлением 2 атм (p1), сжали до объема 25 л (V2), тогда его новое давление будет равно:

Зависимость свойств идеальных газов от температуры определяется законом Гей-Люссака: объем газа прямо пропорционален его абсолютной температуре (при постоянной массе: V = kT, где k - коэффициент пропорциональности). Это соотношение записывается обычно в более удобной форме для решения задач:

Например, если 100 л газа, находящегося при температуре 300К, нагревают до 400К, не меняя давления, то при более высокой температуре новый объем газа будет равен

Запись объединенного газового закона pV/T= = const может быть преобразована в уравнение Менделеева-Клапейрона:
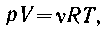
где R - универсальная газовая постоянная, a  - число молей газа.
- число молей газа.
Уравнение Менделеева-Клапейрона позволяет проводить самые разнообразные вычисления. Например, можно определить число молей газа при давлении 3 атм и температуре 400К, занимающих объем 70 л:

Одно из следствий объединенного газового закона: в равных объемах различных газов при одинаковой температуре и давлении содержится одинаковое число молекул. Это Закон Авогадро (А. Авогадро, 1811)
Следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности, при нормальных условиях, т.е. при 0 С (273К) и
101,3 кПа, объем 1 моля газа, равен 22,4 л. Этот объем называют молярным объемом газа Vm.
Таким образом, при нормальных условиях (н.у.) молярный объем любого газа Vm = 22,4 л/моль.
Закон Авогадро используется в расчетах для газообразных веществ. При пересчете объема газа от нормальных условий к любым иным используется объединенный газовый закон Бойля-Мариотта и Гей-Люссака:

где Рo, Vo, Тo - давление, объем газа и температура при нормальных условиях (Рo = 101,3 кПа, Тo = 273К).
Если известна масса (m) или количество (n) газа и требуется вычислить его объем, или наоборот, используют уравнение Менделеева - Клапейрона:
PV = n RT,
где = m/M - отношение массы вещества к его молярной массе,
R - универсальная газовая постоянная, равная 8,31 Дж/(моль*К).
Из закона Авогадро вытекает еще одно важное следствие: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта постоянная величина называется относительной плотностью газа и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равно этой постоянной:

где М1 и М2 - молярные массы двух газообразных веществ.
Величина D определяется экспериментально как отношение масс одинаковых объемов исследуемого газа (М1) и эталонного газа с известной молекулярной массой (М2). По величинам D и М2 можно найти молярную массу исследуемого газа:
M1 = D M2.
Пример 1. Углекислый газ объемом 1 л при нормальных условиях имеет массу 1,977 г. Какой реальный объем занимает моль этого газа (при н. у.)? Ответ поясните.
Решение. Молярная масса М (CO2) = 44 г/моль, тогда объем моля 44/1,977 = 22,12 (л). Эта величина меньше принятой для идеальных газов (22,4 л). Уменьшение объема связано с возрастанием взаимодействия между молекулами СО2, т. е. отклонением от идеальности.
Пример 2. Газообразный хлор массой 0,01 г, находящийся в запаянной ампуле объемом 10 см3, нагревают от 0 до 273oС. Чему равно начальное давление хлора при 0oС и при 273oС?
Решение. Мr(Сl2) =70,9; отсюда 0,01 г хлора соответствует 1,4  10-4 моль. Объем ампулы равен 0,01 л. Используя уравнение Менделеева-Клапейрона pV=vRT, находим начальное давление хлора (p 1 ) при 0oС:
10-4 моль. Объем ампулы равен 0,01 л. Используя уравнение Менделеева-Клапейрона pV=vRT, находим начальное давление хлора (p 1 ) при 0oС:

аналогично находим давление хлора (р2)при 273oС: р2 = 0,62 атм.
Пример 3. Чему равен объем, который занимают 10 г оксида углерода (II) при температуре 15oС и давлении 790 мм рт. ст.?
Дата добавления: 2015-09-10; просмотров: 132 | Поможем написать вашу работу | Нарушение авторских прав |