
Читайте также:
|
Свойства спиртов ROH определяются наличием полярных связей Od-–Hd+ и Cd+–Od-, и неподеленных электронных пар на атоме кислорода.

При реакции спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы) или O–H (с отщеплением водорода). Это могут быть реакции замещения, в которых происходит замена OH или H, или элиминирование (отщепление), когда образуется двойная связь. На реакционную способность спиртов большое влияние оказывает строение радикалов, связанных с гидроксильной группой.
I. Реакции с разрывом связи RO–H
1. Спирты реагируют с щелочными и щелочноземельными металлами, образуя солеобразные соединения – алкоголяты. Со щелочами спирты не взаимодействуют.
2СH3CH2CH2OH + 2Na ® 2СH3CH2CH2ONa + H2
2СH3CH2OH + Сa ® (СH3CH2O)2Ca + H2
В присутствии воды алкоголяты гидролизуются:
(СH3)3С–OK + H2O ® (СH3)3C–OH + KOH
Это означает, что спирты – более слабые кислоты, чем вода.
2. Взаимодействие с органическими кислотами (реакция этерификации) приводит к образованию сложных эфиров.
| O II | O II | ||||
| CH3– | C- | -OH + H - | -OC2H5 H2SO4® CH3– | C | –O–C2H5(уксусноэтиловый эфир (этилацетат)) + H2O |
В общем виде:
| O II | H+ | O II | |||||
| R– | C- | -OH + H- | -OR’ | ® | R– | C | –O–R’ + H2O |
II. Реакции с разрывом связи R–OH.
1. С галогеноводородами:
R–OH + HBr «R–Br + H2O
2. С концентрированной серной кислотой:
| C2H5O- | -H + H–O | O | C2H5O | O | ||
| \ // S / \\ | ® | \ // S (этилсерная кислота) + H2O / \\ | ||||
| H–O | O | H–O | O |
| C2H5–O | O | C2H5O | O | |||
| \ // S / \\ | ® | \ // S (диэтилсерная кислота(диэтилсульфат)) + H2O / \\ | ||||
| C2H5O- | -H + H–O | O | C2H5O | O |
III. Реакции окисления
1. Спирты горят:
2С3H7ОH + 9O2 ® 6СO2 + 8H2O
2. При действии окислителей:
a) первичные спирты превращаются в альдегиды (или в карбоновые кислоты)
| O II | O II | |||||||
| R- | -CH2–OH | (первичный спирт) ––[O]® | R- | -C | (альдегид) ––[O]® | R- | -C | (карбоновая к-та) |
| I H | I OH |
| K2Cr2O7 | O II | K2Cr2O7 | O II | |
| CH3–CH2–OH | ––––® | CH3–C | ––––® | CH3–C |
| H2SO4 | I H | H2SO4 | I OH |
| O II CH3OH + CuO ––t°® H–C I H | + Cu + H2O |
b) вторичные спирты окисляются до кетонов
| R- | -CH- | -R’(вторичный спирт) ––[O]® | R- | -C- | -R'(кетон) |
| I OH | II O |
| CH3– | CH–CH2–CH3 I OH | ––K2Cr2O7,H2SO4® | CH3– | C–CH2–CH3 II O |
c) третичные спирты устойчивы к действию окислителей.
IV. Дегидратация
Протекает при нагревании с водоотнимающими реагентами.
1. Внутримолекулярная дегидратация приводит к образованию алкенов
CH3–CH2–OH ––t°>140°C,H2SO4® CH2=CH2 + H2O
| CH3 \ | CH3 I | |||
| CH3–C– | CH–CH3 | ––t°,H2SO4® | CH3– | C=CH–CH3 + H2O |
| I HO | I H |
При отщеплении воды от молекул вторичных и третичных спиртов атом водорода отрывается от соседнего наименее гидрогенизированного атома углерода; образующийся алкен содержит наибольшее число заместителей при двойной связи (правило Зайцева).
2. Межмолекулярная дегидратация даёт простые эфиры
| R- | -OH + H- | -O–R –– t°,H2SO4® R–O–R(простой эфир) + H2O |
| CH3–CH2- | -OH + H- | -O–CH2–CH3 ––t°<140°C,H2SO4® CH3–CH2–O–CH2–CH3(диэтиловый эфир) + H2O |
Обе реакции конкурируют между собой. Увеличение температуры и разбавление инертным растворителем благоприятствуют внутримолекулярному процессу.
Многоатомные спирты
Получение
1. Этиленгликоль (этандиол-1,2) синтезируют из этилена различными способами:

3CH2=CH2 + 2KMnO4 + 4H2O ® 3HO–CH2–CH2–OH + 2MnO2 + 2KOH
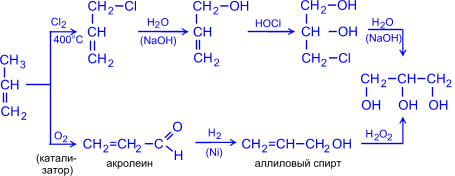
2. Глицерин (пропантриол -1,2,3) получают гидролизом жиров (см. "Жиры") или из пропилена по схемам:
Дата добавления: 2015-09-11; просмотров: 68 | Поможем написать вашу работу | Нарушение авторских прав |