
Читайте также:
|
В том же году, когда была опубликована теория И. Бренстеда, Г. Льюис подошел к проблеме кислот и оснований с такой стороны, что стало возможным объединение всех существующих теорий кислот и оснований. Опираясь на теорию строения атомов и молекул, Льюис очертил контуры электронной теории кислот и оснований. Г. Льюис считает, что ограничение группы кислот веществами, которые содержат водород, так же серьезно препятствует глубокому пониманию химических явлений, как и ограничение окислителей веществами, содержащими кислород. Льюис возражает против «культа протона», который ярко выражен в теории Бренстеда. Исходя из наиболее общих свойств всех кислот или оснований — их электронного строения, Льюис определяет кислоты как вещества, способные присоединять (акцептировать) пару неподеленных электронов от основания, а основания – как вещества, способные отдавать пару неподеленных электронов, т е. быть донорами электронов.
Как отмечает Шатенштейн, отличительным признаком кислот и оснований, по электронной теории, является их взаимная нейтрализация, осуществляемая путем образования ковалентной связи между атомом основания, обладающим свободной парой электронов, и атомом кислоты, в дефицитную электронную оболочку которой включается эта пара электронов В продукте нейтрализации электронная пара обобществлена между соответствующими атомами. Этим кислотно-основной процесс отличается от окислительно-восстановительного, в котором электроны передаются полностью от восстановителя к окислителю. При таком подходе к понятиям «кислота» и «основание» в число кислот попадают не только те вещества, которые содержат водород, способный переходить к другому веществу (основанию) в виде протона (теория кислот Бренстеда), но и те вещества, которые не содержат водород. Иначе говоря, по Льюису, кроме водородсодержащих кислот существуют также апротонные кислоты. Такие соединения как BCl3,AlCl3,FeCl3 по теории Льюиса могут быть причислены к кислотам, так как способны при взаимодействии с основаниями присоединять свободную пару электронов:

Апротонные кислоты так же, как и водородные, способны катализировать реакции и изменять окраску индикаторов. Так, кристаллический фиолетовый окрашен в желтый цвет в кислых растворах и в фиолетовый—в щелочных, что можно наблюдать, применяя соответственно водные растворы НС1 и NaOH. В неводных растворителях, например, в хлорбензоле, растворенные НС1, BCl3 и SnCl4 вызывают желтую окраску кристаллического фиолетового. С другой стороны, амины, пиридин и тому подобные вещества в той же среде ведут себя как типичные основания, о чем можно судить по окрашиванию раствора в фиолетовый цвет.
Таким образом, реакции кислот с основаниями по Льюису, сводятся к образованию координационно-ковалентной связи между молекулами кислоты и основания и их взаимной нейтрализации. Некоторым недостатком электронной теории Льюиса является то, что в рамки этой теории не вполне укладываются водородные кислоты. Например, для объяснения реакции взаимодействия между НС1 и NH3 нужно допустить двухвалентность водорода:

Это, конечно, противоречит теории строения вещества. Поскольку протон легко присоединяет электрон, то он, по Льюису, относится к сильным кислотам:

Бренстедовские кислоты Льюис формально рассматривает как продукты нейтрализации протона основаниями. Так, НС1 с этой точки зрения является продуктом нейтрализации Н+ основанием С1–:

Ион гидроксония (водородная кислота) является продуктом нейтрализации:
H+ + H2O = H3O+
Ион аммония (водородная кислота) представляет собой продукт нейтрализации:

Как видно из вышесказанного, понятия кислоты и основания, введенные Льюисом, охватывают гораздо большее число соединений, в том числе соединения, которые являются кислотами или основаниями по Бренстеду и Аррениусу.
В теории Льюиса, которую называют также теорией обобщенных кислот и оснований, различаются первичные и вторичные кислоты и основания. К первичным кислотам Льюис относит те кислоты, которые легко, «без задержки» соединяются с основаниями и не требуют для этого энергии активации. К вторичным кислотам Льюис относит вещества, ведущие себя подобно кислотам, но имеющие электронные формулы, обычное начертание которых не показывает, что они могут выступить в качестве акцепторов электронных пар. Со вторичными кислотами реакция нейтрализации протекает, как правило, медленно и требует энергий активации. Эти вещества обычно не являются кислотами, но могут становиться ими в результате возбуждения. В качестве примера можно привести известные реакции взаимодействия альдегидов с аммиаком, где альдегид по отношению к аммиаку ведет себя как кислота. Объясняется это тем, что электроотрицательный атом кислорода в альдегиде оттягивает к себе электроны от атома углерода. В результате этого электронная плотность у углерода уменьшается и он заряжается положительно, а кислород – отрицательно:

В этом случае альдегид, согласно теории Льюиса, может реагировать как кислота, так как углеродный атом, имеющий лишь шесть электронов,будет стремиться достроить свою электронную оболочку до октета за счет электронов другого вещества (основания):

Установлено, например, что кривые потенциометрического титрования изотиоционатов аминами имеют такую же форму, что и кривые титрования обычных кислот щелочью. Следовательно, реакция взаимодействия аллилизотиоцианата с аминами также носит кислотно-основной характер. Такое, на первый взгляд, необычное заключение относительно кислотных свойств изотиоцианата совпадает с представлениями, вытекающими из теории кислот и оснований Льюиса. Можно считать, что аллилизотиоцианат, аналогично альдегидам, представляет собой вторичную кислоту (по Льюису), так как в его молекуле имеется электроотрицательный атом серы, который оттягивает электроны от соседнего углеродного атома, в результате чего молекула поляризуется. Под влиянием аминов эта поляризация еще более усиливается и, в итоге, приводит к разрыву одной двойной связи между серой и углеродом по схеме:

При этом у углеродного атома остается лишь шесть электронов, поэтому он легко присоединяет к себе неподеленную пару электронов от азота амина. Следовательно, взаимодействие аллилизотиоцианата с аминами, исходя из теории кислот и оснований Льюиса, также можно отнести к кислотно-основным реакциям:

При смешении аллилизотиоцианата с аминами параллельно протекают реакции, приводящие к образованию электролитных соединений:
C3H5–N=C=S + R—NH2 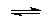 [R–NH2+C3H5][NCS]–
[R–NH2+C3H5][NCS]–
Нетрудно показать, что и эти реакции, с точки зрения Льюиса, являются реакциями кислотно-основного взаимодействия. В данном случае аллилизотиоцианат также ведет себя как вторичная кислота, так как углеродный атом в аллилизотиоцианате по тем же причинам заряжается положительно и способен присоединять неподеленную пару электронов от азота амина:

Электронная теория кислот и оснований не является столь же четкой и количественной, как Бренстедовская теория протолитического равновесия. Однако она не только дополняет и расширяет круг веществ с кислотно- основными свойствами, но и более глубоко объясняет наличие этих свойств, исходя из теории строения вещества. Хотя чаще всего для объяснения кислотных и основных свойств пользуются теориями Льюиса и Бренстеда, есть еще много разных классификаций.
Дата добавления: 2015-09-11; просмотров: 140 | Поможем написать вашу работу | Нарушение авторских прав |