
Читайте также:
|
Первые представления о кислоте и основании основывались естественно на опыте. Еще в глубокой древности были замечены особые свойства уксуса, образующегося при скисании вина. Кислый вкус,способность створаживать молоко, растворять металлы и другие вещества, воздействовать на красители - это особенности уксуса и других похожих на него веществ, которые привели к выделению кислот в особую группу. В латинском языке слова, означающие уксус и кислоту, звучат почти одинаково: acetum и acidum. Т. Парацельс (1493–541) назвал общее свойство кислот - principium acidum.
Что касается щелочей или оснований, то много веков тому назад было замечено, что зола, получающаяся при сгорании растений и смешанная с водой, очищает загрязненные предметы и ткани. Позднее из водной вытяжки золы выделяли белое вещество, называемое у европейцев - поташ (англ. pot - горшок, ashes - зола), у арабов – algali (зола). Моющие свойства этих соединений, особый вкус и, главное, способность "вскипать" при взаимодействии с кислотами являются отличительными признаками щелочей. Г. Шталь (1660–1734) называл щелочами любые вещества, имеющие сродство к кислотам и соединяющиеся с ними; при этом исчезают сами вещества и их особенные свойства.
Первые теории, классификации и систематизация кислот и щелочей сделаны в ХVII-XVIII веках Р. Бойлем, К. Бехером, Г. Шталем,М. Ломоносовым. К концу XVIII века были открыты все важнейшие неорганические кислоты и некоторые из органических. Кислоты отличали по кислому вкусу и способности менять цвет растительных красок. Основаниями считали все вещества, нейтрализующие кислоты и образующие с ними соли. Подробно и очень интересно история развития концепции кислот и основания написана известным советским ученым А.И. Шатенштейном [1]. Здесь будут лишь кратко рассмотрены основные теории кислот и оснований.
Изучая законы горения веществ А. Лавуазье обнаружил (1778), что многие из низ объединясь с кислородом в процессе горения, дают типичные кислоты.Он высказал мысль, что носителем кислотных свойств является кислород. Однако уже в 1789 году К. Бертолле установил, что кислотные свойства проявляют синильная кислота и сероводород. И, напротив,оксиды металлов проявляют не кислотные, а основные свойства. Решающий удар по кислородной теории А. Лавуазье был нанесен позже в работах Ж. Гей-Люссака и Л. Тенара (Франция, 1811г.) и Д. Гэмфри (Англия, 1810), которые не смогли обнаружить кислород в муриевой и оксимуриевой кислотах (хлористом водороде и хлоре). Было предложено такие кислоты отнести к новому классу соединений под названием бескислородные кислоты. Эта точка зрения существовала недолго и была уточнена после того, как Либих (1833 г.) доказал, что гораздо проще рассматривать кислоты как соединения, содержащие водород, который может быть замещен на металл.
Дорога к познанию кислот была подготовлена целым рядом достижений в области физической химии (законы М. Фарадея, Ф. Рауля, Я. Вант-Гоффа и др.) и окончательно открыта теорией электролитической диссоциации С. Аррениуса, появившейся в период 1880 –1890 г. Новые представления о процессе ионизации соединений позволили С. Аррениусу сформировать ионную теорию кислот и оснований, которая была первым приближением к современным взглядам на кислоты и основания. Согласно Аррениусу, кислота – это водородсодержащее соединение, которое в водном растворе образует ионы водорода,а основание – гидроксилсодержащее соединение, которое в водном растворе образует ионы гидроксила. Обязательным условием кислотно-основного взаимодействия, по С. Аррениусу, является реакция по схеме:
H+ + OH– 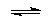 H2O
H2O
Эта теория хорошо объясняет многие экспериментальные данные, относящиеся к водным растворам кислот и оснований. Например, хорошо известно, что химическая активность водных растворов кислот и оснований и их каталитическое действие тем выше, чем лучше растворы этих веществ проводят электрический ток. Высокая электропроводность указанных растворов, согласно теории электролитической диссоциации Аррениуса, объясняется распадом молекул кислоты и основания на ионы с образованием ионов H+ и ОН–.
Теория объяснила, почему растворы различных кислот одной и той же концентрации обладают различной проводимостью и проявляют различную химическую активность. Дело в том, что вещества, при диссоциации которых создается высокая концентрация Н+, являются сильными кислотами. Те кислоты, степень диссоциации которых в воде незначительна, представляют собой слабые кислоты и слабее проводят ток.
Работы В. Оствальда (1888 г.) явились ярким подтверждением теории С. Аррениуса. В соответствии с законом В. Оствальда зависимость степени диссоциации a от разбавления раствора слабого электролита и ввел понятие о константе диссоциации:

где V—объем раствора, a - степень диссоциации.
Уравнение показывает, что константа диссоциации кислот и оснований может служить мерой их «силы». Однако многие факты указывали на то, что молекулы кислоты в воде не просто распадаются на ионы, но претерпевают более глубокие изменения. Так, чистый жидкий хлористый водород почти не проводит электрический ток, в то время как соляная кислота является прекрасным проводником. Точно так же и химические свойства жидкого или газообразного HCl во многом отличаются от химических свойств соляной кислоты. Это объясняется тем, что в водном растворе хлористый водород вступает во взаимодействие с водой с образованием иона гидроксония (Н30+)
HCl + H2O  Cl– + H3O+
Cl– + H3O+
Таким образом, хотя теория С. Аррениуса и объясняет многие факты проявления кислотных и основных свойств веществ в водных растворах, она не учитывает взаимодействия растворенного вещества с растворителем и образования гидратированных (сольватированных) ионов.
По мере дальнейшего накопления экспериментальных данных, особенно о свойствах неводных растворов, выяснилось, что теория Аррениуса имеет и ряд других недостатков. Во-первых, она применима только для водных растворов и не объясняет огромное число реакций кислотно-основного характера, протекающих в неводных растворах. Такие характерные свойства кислот и оснований, как обратимое изменение ими окраски индикаторов, способность катализировать химические реакции, наблюдаются и в таких растворах, в которых ионы Н3О+ и ОН– отсутствуют, как например, в бензольных растворах, где кислоты ассоциированы. Во-вторых, очень много реакций не укладывается в схему кислотно-основного взаимодействия С. Аррениуса. Например, реакция
CH3COOH + NH3  CH3COONH4
CH3COONH4
безусловно является примером кислотно-основного взаимодействия, однако идет в отсутствие воды. Точно так же в реакциях:
RNH2 + HCl (г)  RNH3Cl
RNH3Cl
NH3(г)+ HCl (г)  NH4Cl
NH4Cl
отсутствуют как ионы гидроксила, так и водородный ион, так как хлористый водород в газообразном состоянии при обычных температурах не распадается на ионы.
Введение в круг исследования неводных растворов и рассмотрение растворов как своеобразных химических систем привело к пересмотру взглядов на кислоты и основания. Особенно большие заслуги в этом отношении принадлежат русской школе физико-химиков. Из классических трудов Д. И. Менделеева, И. А. Каблукова, Д. П. Коновалова и других авторов со всей убедительностью следовал вывод, что свойства растворов кислот, в частности их электропроводность, преимущественно зависят от химических превращений, которые кислоты претерпевают при взаимодействии с растворителем. Когда химическая реакция между кислотой и растворителем (например, углеводородом) исключена, раствор не проводит тока. Следовательно, положение теории С. Аррениуса о том, что электролитическая диссоциация представляет собой чисто физический процесс, является ошибочной.
Химическая теория кислот была развита в многочисленных работах А. Ганча, публиковавшихся в течение почти сорока лет (1899-1935 гг.). В противовес физической теории он разработал химическую теорию кислот, описывающую ионизацию кислот как химический процесс взаимодействия с растворителем. А. Ганч подтвердил открытие И. А. Каблукова, Д.П. Коновалова и других, что ионизация кислот вызвана химической реакцией с растворителем и что в растворе отсутствуют несольватированные Н-ионы. В теории Ганча предусматривалась ионизация кислот не только в воде, но и в неводных растворителях и учитывалось влияние природы растворителя на поведение в нем кислот и на особенности получающихся растворов. А. Ганч ввел в химию новое понятие о псевдокислотах и псевдооснованиях - соединениях, нейтрализация которых сопровождается внутримолекулярными перегруппировками. Наконец, теория С. Аррениуса не объясняла взаимодействия между кислотами. Между тем, в работах А. Ганча и других авторов на многочисленных примерах показано наличие химического взаимодействия между кислотами. При помощи различных методов физико-химического анализа системы азотная кислота — уксусная кислота установлено, что между компонентами этой системы происходит химическое взаимодействие с образованием нового химического соединения:
CH3COOH + HNO3  [CH3COOH2]+[NO3]–
[CH3COOH2]+[NO3]–
Таким образом, с развитием химии теория Аррениуса оказалась несостоятельной. Все многообразие кислот и оснований было сведено к двум простейшим ионам - иону водорода и иону гидроксила. Определение понятий "кислота" и "основание", вытекающие из теории электролитической диссоциации, предусматривают только водные растворы и не учитывают химического взаимодействия между растворенным веществом и растворителем. Таково состояние теории кислот и оснований к началуХХ века.
Дата добавления: 2015-09-11; просмотров: 116 | Поможем написать вашу работу | Нарушение авторских прав |