
Читайте также:
|
1. Спирти виявляють слабкі кислотні властивості, обумовлені високою полярністю зв’язку в гідроксильній групі:  .
.
З лужними металами утворюють алканоляти: 2СН3СН2ОН+2Na→2СН3СН2ONa+Н2
натрій етилат
Вода виявляє сильніші кислотні властивості, тому алканоляти піддаються гідролізу:
СН3СН2ОNa + H2O →СН3СН2OH + NaOH.
2. Взаємодія з карбоновими кислотами в присутності Н2SО4,конц. при нагріванні в результаті дає естери (складні ефіри). Це – реакція етерифікації:

Реакції гідроксилу
1. Взаємодія з галагеноводнями призводить до заміщення ОН-групи на галоген:
СН3СН2ОН + HCl →СН3СН2Cl + Н2O
хлоретан
2. Взаємодія з галагенідом фосфору, сульфуру - хлористим тіонілом, SOC12 :
СН3 - СН2ОН + РВг5 → СН3 - СН2Вг + РОВг3 + НВг,
СН3 - СН2ОН + SOC12 → СН3 - СН2С1 + SO2 + НС1,
3. Дегідратація спиртів в з алежності від умов реакції може відбуватися внутрішньомолекулярною або міжмолекулярною.
Внутрішньомолекулярна дегідратація спиртів відбувається у присутності концентрованих H2SO4 або H3РO4 та алюміній оксиду з утворенням алкенів:

При нижчій температурі та наявності каталітичної кількості мінеральної кислоти відбувається міжмолекулярна дегідратація з утворенням етерів:
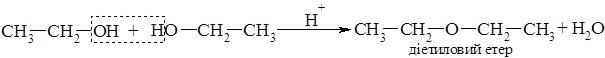
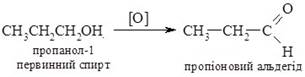
4. Реакції окиснення. Первинні та вторинні спирти легко окиснюються з утворенням відповідно альдегідів та кетонів. Окисники – KMnO4 або хромова суміш, кімнатна температура:

Третинні спирти окиснюються в жорстких умовах з розривом С–С зв’язків і утворенням суміші карбонових кислот.
7. Г оріння спиртів: С2Н5ОН + 3О2 → 2СО2 + 3Н2О
8. Окислення етанолу хромовою сумішшю при нагріванні до оцтового альдегіду (запах яблук), розчину стає зеленим:
3 CH3–CH2(ОН)+6K2Cr2O7+4 H2SO4→CH3–COH+Cr2(SO4)3+K2SO4+7 H2O
Дата добавления: 2015-09-11; просмотров: 106 | Поможем написать вашу работу | Нарушение авторских прав |